Вероятность рака при атрофическом гастрите
Содержание статьи
Почему атрофический гастрит называют предраковым состоянием?
Когда гастроэнтерологи говорят, что атрофический гастрит – это предраковое состояние, они не нагнетают. Это действительно самая опасная разновидность гастрита: риск развития рака желудка в 5 раза выше, чем при гастрите без атрофии. По данным Всемирной организации здравоохранения, в 13% случаев атрофический гастрит заканчивается онкологией. Что такое атрофия, откуда она берётся и при каких условиях трансформируется в рак, рассказываем далее.
Откуда берётся атрофия
Если говорить о слове «атрофия» в общем, то это процесс, при котором снижается или полностью прекращается функция какого-либо органа. Гастрит – воспалительное заболевание желудка. Когда воспаление сопровождается отмиранием обкладочных желез (они вырабатывают желудочный сок), гастрит классифицируют как атрофический.
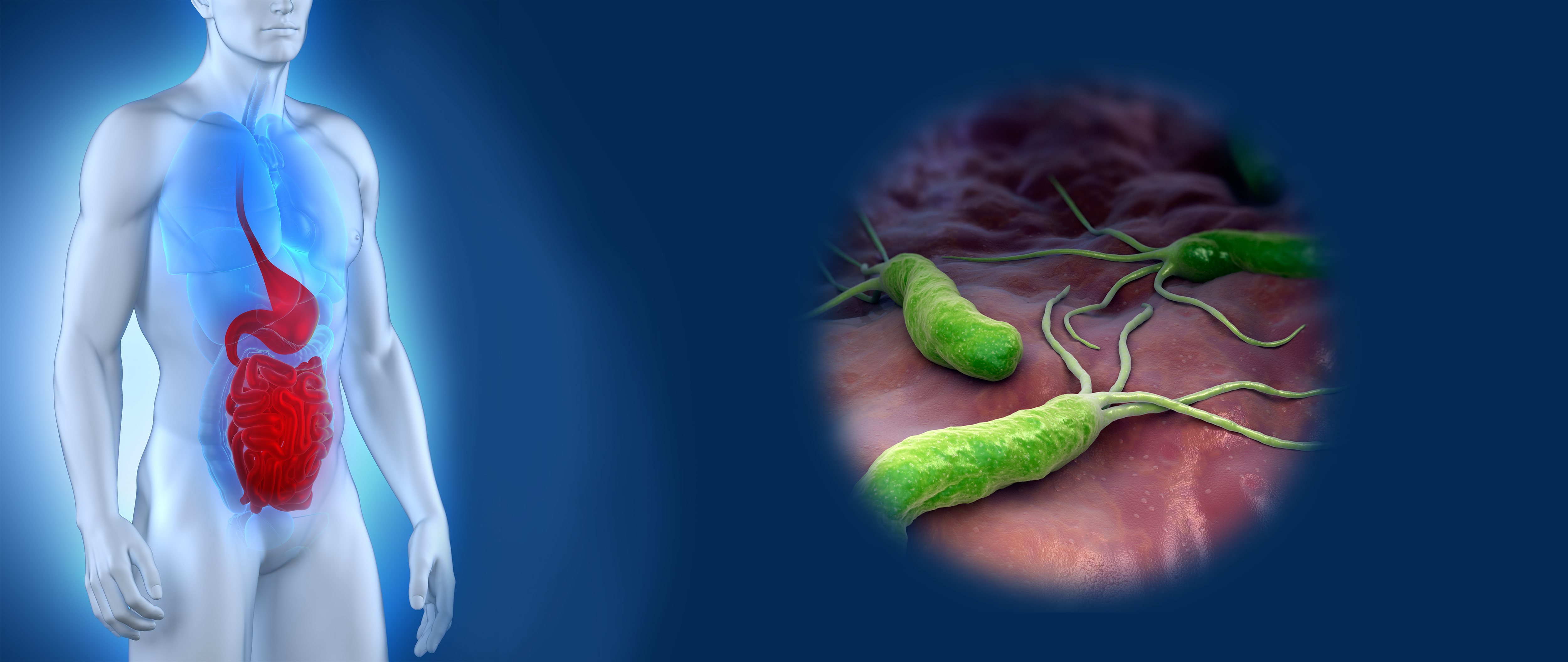
Атрофия обычно развивается на фоне длительно существующей хеликобактерной инфекции, которая сопровождается аутоиммунным процессом: собственные антитела организма «набрасываются» на клетки обкладочных желез желудка и повреждают их. Возникновению атрофического гастрита также способствует стресс, злоупотребление алкоголем, бесконтрольный приём лекарств, другие заболевания.
Примерно у половины пациентов с гастритом, вызванным Helicobacter pylori (он является причиной 90% случаев гастрита), развивается атрофия.
Гастроэнтерологи называют атрофический гастрит предраковым состоянием. Для того, чтобы развился рак желудка (аденокарцинома желудка) требуются годы, но, если человек не испытывает тяжёлых симптомов (так часто и бывает), онкология становится более чем реальной.
По данным Всемирной организации здравоохранения, рак желудка занимает шестое место по распространённости на Земле и третье по смертности. Ежегодно от него погибает около 800 тысяч человек.
Как Helicobacter pylori «проедает» слизистую?
Желудок выстлан слизистой оболочкой, которая защищает его от соляной кислоты, опасных бактерий и токсинов. Helicobacter pylori атакует слизистую, ослабляет её защитные свойства, делает проницаемой и подверженной воздействию агрессивных факторов. Это вызывает нарушения в работе пищеварительной системы и всего организма в целом.
Далее под воздействием Helicobacter pylori и аутоиммунных изменений ткани желудка начинают перерождаться в кишечные. Этот процесс называется кишечной метаплазией. Чем дальше зашла метаплазия, тем больше вероятность развития рака желудка.
Площадь атрофии – основной показатель риска рака желудка. Если метаплазия распространена на 20% слизистой, то вероятность онкологии достигает почти 100%. По статистике, 13% случаев хронического атрофического гастрита заканчиваются злокачественной опухолью.
Как вылечить атрофический гастрит?
Успешность лечения напрямую зависит от запущенности атрофического гастрита. Но в любом случае, лучше обнаружить это заболевание, чем рак. Полное восстановление структуры слизистой оболочки при тяжелой атрофии требует очень длительного времени, в ряде случаев это вообще невозможно. Поэтому больные с таким диагнозом обязаны постоянно соблюдать диету, принимать определённые лекарства и наблюдаться у врача.
Основные шаги лечения:
- Восстановление слизистой оболочки – это главное, к чему нужно стремиться пациенту с атрофическим гастритом. Поэтому гастроэнтеропротектор (ребамипид) необходим на всех этапах лечения. Он защищает слизистую и помогает ей вернуть целостность;
- Уничтожение бактерии Helicobacter pylori обязательно, без этого развитие атрофического гастрита не остановить. Сейчас врачи назначают два антибиотика и антисекреторный препарат (ИПП);
- Нормализация моторики желудочно-кишечного тракта при помощи прокинетиков (итомед) – пища не будет застаиваться в желудке;
- Лечебная диета Стол №1 или Стол №5. Главные принципы – химически, термически и механически щадящая пища;
- При пониженной кислотности желудка необходимы препараты для повышения секреции соляной кислоты, при повышенной кислотности – наоборот, антисекреторные препараты.
Пациентам с атрофическим гастритом даже при соблюдении всех рекомендаций необходимо регулярно обследовать желудок и кишечник (потому что органы взаимосвязаны). Ежегодная диагностика включает гастроскопию, гастропанель (она позволяет оценить площадь атрофии) и анализ на Helicobacter pylori. Колоноскопию при отсутствии болезненных симптомов со стороны кишечника достаточно делать раз в пять лет. Правда, это показано даже здоровым людям после 50 лет, потому что в этом возрасте велик риск развития рака кишечника.
Обращаем ваше внимание! Эта статья не является призывом к самолечению. Она написана и опубликована для повышения уровня знаний читателя о своём здоровье и понимания схемы лечения, прописанной врачом. Если вы обнаружили у себя схожие симптомы, обязательно обратитесь за помощью к доктору. Помните: самолечение может вам навредить.
Источник
Хронический гастрит и рак желудка
Рак желудка – одно из самых распространенных злокачественных заболеваний в мире, где оно занимает 5 место в структуре онкологических болезней и 2 место в структуре смертности от онкопатологии. В России рак желудка занимает пятое место в структуре заболеваемости злокачественными новообразованиями у мужчин и шестое место – у женщин.
Широкая распространенность этой болезни и низкий процент пятилетней выживаемости (в среднем по миру 10-20%) заставляет специалистов по всему миру активно искать алгоритмы своевременной диагностики не столько рака желудка, сколько предраковых заболеваний.
С учетом локализации поражения принято выделять два основных типа рака желудка: кардиальный (поражение кардиального отдела) и некардиальный рак (тело и/или выходной отдел желудка).
Хронический гастрит – маленький шаг на пути к раку желудка
Такое пугающее название подзаголовка достаточно точно отражает текущее понимание этапов развития рака желудка. Само заболевание «хронический гастрит» обычно не вызывает явных симптомов. А вот наличие типичных проявлений болезни, таких как боли в животе, чувство тяжести, переполнения после еды, тошнота – это симптомы функциональной диспепсии, до сих пор неверно определяемой не только пациентами, но даже врачами-гастроэнтерологами как хронический гастрит.
Итак, хронический гастрит – заболевание, которое не проявляется симптомами, а диагноз подтверждается только на основании гистологического исследования биоптатов желудка. Врач-морфолог, выполняющий исследование, может выявить воспаление в слизистой оболочке различной степени выраженности. Это и есть хронический гастрит.
У определенной части лиц длительное воспаление в слизистой желудка (хронический неатрофический гастрит) может привести к развитию атрофических изменений, а иногда клетки желудка могут замещаться нетипичными кишечными клетками (так называемая кишечная метаплазия).
Кишечная метаплазия повышает риск развития дисплазии – предракового заболевания, которое со временем может трансформироваться в аденокарциному (рак) желудка.
Эти этапы, сменяющие друг друга, – хронический гастрит без атрофии, атрофический гастрит, кишечная метаплазия, дисплазия, рак желудка – получили название «каскад Корреа» по имени автора, который описал данную последовательность.
Причины хронического гастрита
Поскольку воспалительные изменения в слизистой желудка, т.е. гастрит – начальные этапы развития рака желудка, попробуем разобраться, откуда же возникает это заболевание. Давно уже доказано, что нерегулярное питание, еда всухомятку и другие нарушения режима приема пищи не вызывают гастрит. Скорее, эти факторы могут способствовать обострению функциональной диспепсии. Тогда что же, образно выражаясь, подкидывает дрова в топку воспаления в слизистой оболочке желудка?
На сегодняшний день выделено несколько факторов, которые доказано вызывают развитие воспаления в желудке:
- инфекция, прежде всего инфекция Helicobacter pylori (H.pylori);
- аутоиммунное воспаление;
- воспаление в ответ на химическое повреждение (например, желчью при дуодено-гастральном рефлюксе).
Конечно, существуют и другие причины, но их вклад в развитие воспаления в желудке можно считать незначительным.
Инфекция H.pylori в настоящее время рассматривается как основной фактор, вызывающий развитие хронического гастрита. Около 44% населения земного шара инфицированы этим возбудителем. Известно, что распространенность атрофического гастрита на фоне инфекции H.pylori риска варьирует от 8% в Западных странах до 84% в Японии и Китае. H.pylori считается наиболее значимым фактором риска развития некардиального рака желудка.
Аутоиммунное воспаление встречается намного реже, однако также приводит к развитию хронического гастрита, нередко с атрофией, и ассоциировано с повышенным риском развития рака желудка.
Факторы риска развития аденокарциномы (рака) желудка
1) Наследственная предрасположенность.
Известно, что риск развития рака желудка у родственников первой степени родства (родители, дети) повышен в 2,3-3,5 раза. При указании на 2 и более случаев рака желудка у ближайших родственников этот риск возрастает в 5-12 раз. Риск выше в тех случаях, когда онкопатология желудка была выявлена у родственников в возрасте менее 50 лет.
2) Аутоиммунное поражение желудка с развитием пернициозной (В12-дефицитной) анемии.
Для аутоиммунного поражения желудка помимо развития атрофии характерно также разрушение внутреннего фактора (фактора Кастла), который обеспечивает нормальное всасывание витамина В12 в тонкой кишке. Установлено, что аутоиммунный гастрит повышает риск развития аденокарциномы (рака) желудка в 2-6,8 раз.
3) Этнические факторы.
Установлено, что риск развития рака желудка выше у азиатов по сравнению с белыми (в 2,1 раза) и лицами негроидной расы (в 1,7 раза). Среди лиц азиатской расы наибольший риск отмечен у китайцев (4,77) и корейцев (7,39). Нельзя исключить, что такое различие обусловлено в том числе высокой частотой инфекции H.pylori у этих лиц и генетическими особенностями.
4) Старший возраст.
Существуют доказательства того, что в разных возрастных группах риск развития рака желудка различается. «Пограничным» считается возраст старше 45 лет, после которого риск развития заболевания повышается в 1,92-3,1 раза. Вероятнее всего, такая взаимосвязь обусловлена длительностью инфицирования H.pylori и возникшего на этом фоне хронического воспаления
5) Мужской пол.
По данным исследований мужчины имеют больший риск развития аденокарциномы (рака) желудка по равнению с женщинами, при этом риск повышен в 1,3-3 раза.
6) Табакокурение.
Курильщики имеют повышенный риск развития рака желудка, локализованного в кардиальном отделе. Вероятность развития заболевания увеличивается в 1,45-2 раза по данным разных исследований.
7) Инфекция H.pylori.
По всей видимости, это наиболее «весомый» фактор риска развития рака желудка, учитывая широкую распространенность этой инфекции по всему миру. Исследования показали, что риск развития некардиального рака желудка у инфицированных лиц увеличен в 12 раз. Примерно у 1% из них в течение жизни развивается аденокарцинома желудка. Риск развития рака кардиального отдела желудка не повышается.
8) Полипы желудка.
Полипы желудка делятся на 3 вида: полипы фундальных желез, гиперпластические полипы и аденоматозные полипы. В полипах фундальных желез размерами более 1 см редко, но выявляет дисплазия и рак (с частотой по 1,9%, соответственно). Для гиперпластических полипов больших (>1 см) размеров характерно нередкое выявление дисплазии (1,9-19%) и, реже злокачественное перерождение (0,6-2,1%). Аденоматозные полипы значительно повышают риск развития аденокарциномы желудка, а при размерах полипов >2 см частота выявления в них аденокарцином достигает по некоторым данным 50%.
9) Атрофический гастрит.
Поскольку атрофический гастрит является одним из этапов в «каскаде Корреа» (см.выше), проводилась оценка риска его трансформации в рак желудка. Согласно современным данным, ежегодный риск перехода атрофического гастрита в рак желудка составляет 0,1-1,2%. Частота выявления рака желудка у пациентов с атрофией в течение 5 лет варьирует от 0,7% (для слабо выраженной атрофии) до 10% (тяжелая атрофия).
10) Кишечная метаплазия.
Как и атрофический гастрит, кишечная метаплазия является одним из этапов «каскада Корреа» на пути к развитию рака желудка. Ежегодный риск перехода кишечной метаплазии в рак желудка составляет 0,25-0,4%. Частота выявления рака желудка у пациентов с кишечной метаплазией в течение 5 лет составляет 5,3-9,8%.
11) Дисплазия.
Дисплазия (предраковое состояние) делится на два типа: низкой и высокой степени. Дисплазия низкой степени имеет ежегодный риск трансформации в рак желудка 0,6%, в то время как для высокой степени – 6%.
Частота выявления рака желудка у пациентов с дисплазией низкой степени в течение 5 лет составляет 0-23%, высокой степени – 60-85%.
Рекомендации по профилактике развития аденокарциномы (рака) желудка
В течение 2019 года были опубликованы рекомендации по диагностике и лечению пациентов с высоким риском аденокарциномы (рака) желудка сразу двумя группами авторов: Британским обществом гастроэнтерологов и коллегией ученых, представленных членами Европейского общества гастроинтестинальной эндоскопии, Европейской группы по изучению Helicobacter pylori и микробиоты, Европейского общества патологов и Португальского общества гастроинтестинальной эндоскопии (т.н. международные рекомендации по лечению предраковых состояний и изменений желудка второго пересмотра (MAPS II). Были даны рекомендации по недопущению развития и своевременному выявлению грозной болезни – рака желудка.
Итак, каковы же рекомендации в отношении профилактики развития рака желудка?
1) Пациенты с хроническим атрофическим гастритом или кишечной метаплазией подвержены риску развития рака желудка.
Комментарий: Наибольший риск отмечается при выявлении атрофии/кишечной метаплазии одновременно в антральном отделе и теле желудка.
2) Лица, проживающие в регионах с высокой частотой рака желудка должны быть тестированы на инфекцию H.pylori.
Комментарий: следует использовать достоверные методы диагностики, включающие дыхательный тест с С13 меченой мочевиной, определение антигена H.pylori в кале или антител к H.pylori класса IgG в крови. Россия относится к регионам с высокой распространенностью рака желудка.
3) Лицам без симптомов в возрасте ≥50 лет с множественными факторами риска (мужской пол, курение табака, наследственность по раку желудка и т.д.) следует проводить скрининговую гастроскопию.
Примечание: скрининг в медицине – это комплекс мероприятий, направленных на выявление заболевания, которое себя никак не проявляет. В данном случае речь идет о проведении гастроскопии лицам без симптомов рака желудка.
Очень важно! Существует несколько видов наследственного рака желудка, для которого характерно более раннее появление (в возрасте до 40 лет).
4) Лицам с высоким риском развития рака желудка (включая гастрит с атрофией и кишечной метаплазией) необходимо проведение регулярной гастроскопии с фотофиксацией и гистологическим исследованием.
Комментарий: согласно данным зарубежных исследований, рак желудка оказывается невыявленным при проведении гастроскопии в 6-11% случаев. Очень важной является медленный осмотр слизистой оболочки желудка и фиксация изображений (фотографии, видеозапись), что позволяет увеличить выявление раннего рака желудка. В клинике «Эксперт» ведется видеозапись всех эндоскопических исследований желудочно-кишечного тракта на обязательной основе.
5) Пациентам с распространенной атрофией и кишечной метаплазией (вовлечение антрального отдела и тела желудка) показана регулярная гастроскопия с биопсией.
Комментарий: частота гастроскопий зависит от многих факторов, включая случаи рака желудка в семье, сохранение инфекции H.pylori, несмотря на адекватное лечение, и т.д.
6) Лицам, имеющим хронический гастрит или гастрит с атрофией на фоне H.pylori, должна быть проведена эрадикационная терапия инфекции.
Комментарий: профилактика развития рака желудка наиболее эффективна в тех случаях, когда пациента начинали лечить от инфекции H.pylori на этапе выявления неатрофического гастрита или гастрита с атрофией.
7) Лечение инфекции H.pylori может быть эффективной мерой в отношении профилактики развития рака желудка у части пациентов, которые уже имеют кишечную метаплазию, дисплазию или рак желудка.
Комментарий: лечение инфекции H.pylori у пациентов с кишечной метаплазией и дисплазией, а также у лиц с удаленной эндоскопическим методом аденокарциномой желудка снижает риск развития/повторного развития рака желудка. Однако профилактический эффект от лечения на этих этапах меньший, чем при хроническом неатрофическом или атрофическом гастрите.
Заключение
Своевременная и адекватная по объему диагностика на этапе «простого гастрита», т.е. до развития атрофии/метаплазии/дисплазии позволяет определиться с рисками развития онкопатологии желудка, подобрать верную тактику, позволяющую избежать развития грозного заболевания.
Источник
ÐÑÑоÑиÑеÑкий гаÑÑÑиÑ
Атрофический гастрит – это хронический гастрит типа А, при котором уменьшается количество желудочных желез, снижается кислотообразующая функция. Считается предраковым состоянием. Проявляется тяжестью и тупыми болями в желудке, тошнотой, изжогой, диспепсическими явлениями, анемией. Наиболее значимыми методами диагностики являются: гастроскопия с забором и гистологией биоптатов, различные исследования для определения наличия хеликобактерной инфекции. Менее информативны гастрография, УЗИ органов брюшной полости. Так как 90% атрофий желудка связаны с воздействием хеликобактерий, специфическое лечение включает в себя эрадикацию инфекции. Назначается заместительная и симптоматическая терапия, санаторное лечение и физиотерапия.
Общие сведения
Атрофический гастрит – хроническое прогрессирующее воспаление слизистой желудка, в результате которого полностью утрачиваются обкладочные железы желудка, происходит постепенная атрофия с последующей метаплазией участков слизистой. Основным признаком, который указывает на высокую вероятность рака, является не вид перестройки клеток, а площадь процесса – при распространенности метаплазии на 20% площади слизистой желудка и более вероятность развития рака практически 100%.
По наблюдениям специалистов в сфере практической гастроэнтерологии, хронический атрофический гастрит в 13% случаев заканчивается развитием онкологической патологии. По сравнению с неатрофическим процессом вероятность такого осложнения при атрофическом гастрите в пять раз выше. Основной задачей гастроэнтерологов сегодня является разработка новых, простых и неинвазивных методов достоверной диагностики атрофии, а также ранней диагностики рака желудка. Замечено, что своевременная диагностика и полная эрадикация инфекционного процесса уже через пять лет приводят к восстановлению слизистой желудка и значительному уменьшению площади метаплазии.
Атрофический гастрит
Причины
Основными причинами развития атрофического гастрита являются длительно текущая хеликобактерная инфекция и аутоиммунный процесс, при котором собственные антитела повреждают G-клетки желудка (они являются основной составляющей обкладочных желез). Атрофии железистого эпителия могут способствовать различные сопутствующие заболевания и состояния: бесконтрольный прием медикаментов, алкоголизм, стрессы и выраженное физическое переутомление, различные профессиональные вредности, наследственные особенности работы ЖКТ, тяжелые фоновые заболевания.
Патогенез
H.pylori вызывает хроническое повреждение клеток, ослабляя местные защитные свойства слизистой желудка, что в результате позволяет токсинам и свободным радикалам беспрепятственно проникать в ткани и повреждать ядра клеток. В финале этого процесса клетки приобретают свойства нескольких типов тканей – так называемые гибридные клетки, которые имеют свойства предраковых. Данный процесс называется кишечная метаплазия. Вначале эти участки слизистой приобретают вид тонкокишечного эпителия, затем толстокишечного. Чем дальше зашел процесс метаплазии, тем больше вероятность развития аденокарциномы желудка. На сегодняшний день хеликобактерная инфекция включена в список биологических канцерогенов, ведь без надлежащего лечения она рано или поздно приводит к раку желудка.
Механизм развития аутоиммунного процесса несколько иной. При этом в организме из-за нарушения иммунитета начинают образовываться антитела, которые распознают собственные ткани желудка как чужеродные. Чаще всего антитела вырабатываются к G-клеткам и фактору Касла, который отвечает за всасывание витамина В12. Из-за этого постепенно снижается кислотность желудка, клетки перестраиваются и начинают производить слизь вместо соляной кислоты. В желудке перестают всасываться железо и витамины, развивается тяжелая пернициозная анемия. Если же аутоиммунному гастриту сопутствует хеликобактерная инфекция, предраковое состояние разовьется гораздо быстрее.
Симптомы атрофического гастрита
Патология развивается медленно, поражение при этом начинается со дна желудка, переходя на его тело, а затем и на остальную слизистую. В начале заболевания особой симптоматики может и не быть, что затрудняет диагностику и мешает раннему началу лечения. После развития полной клинической картины у пациента могут выявляться несколько симптомокомплексов.
Анемический синдром развивается из-за нарушения всасывания железа и витаминов (особенно В12, фолиевой кислоты) в полости желудка. Проявляется он выраженной слабостью, утомляемостью, сонливостью, постоянной усталостью (порой даже нарушается обычная деятельность пациента). Кожные покровы и слизистые бледнеют. Пациент отмечает постоянные боли в языке, жжение, слизистая языка становится лаковой. Также больной предъявляет жалобы на нарушения чувствительности в конечностях, обычно симметричные. Характерны сухие волосы и ломкие ногти, беспокоит одышка при незначительных нагрузках, колющие боли в сердце.
Диспепсический синдром проявляется выраженной тяжестью в эпигастрии, реже тупыми ноющими болями в верхней половине живота. Боли связаны с растяжением стенок желудка пищевыми массами из-за нарушений пищеварения. Также пациента беспокоят изжога (забрасывание кислого содержимого в пищевод), срыгивание (забрасывание пищи из желудка в ротовую полость), отрыжка (непроизвольный выход воздуха из желудка). Сопровождаются эти симптомы тошнотой, иногда рвотой, после которой боль в эпигастрии уменьшается. В рвотных массах – большое количество съеденной пищи, слизь, желчь. Аппетит значительно снижен.
Нарушения пищеварения распространяются на другие отделы ЖКТ – появляется дискомфорт в животе, стул становится неустойчивым – запоры сменяются поносами. По утрам во рту неприятный привкус, беспокоит постоянный запах изо рта. Язык обложен сероватым налетом, на нем видны отпечатки зубов. Нарушенное пищеварение и снижение аппетита могут приводить к потере веса, а при отсутствии лечения – к выраженной алиментарной дистрофии. Развивается полигиповитаминоз, который приводит к значительному снижению иммунитета, присоединению различных инфекций.
Диагностика
Сегодня все больше внимания уделяется ранней неинвазивной диагностике атрофического гастрита. Для этого врачами-гастроэнтерологами разработана специальная панель диагностики. При проведении обычной гастроскопии выявить очаги дисплазии эпителия, а тем более определить их площадь не представляется возможным. Из-за этого зачастую возникают ошибки, связанные как с гипердиагностикой, так и гиподиагностикой: площадь гиперплазии может быть оценена неправильно, а воспалительные изменения могут быть приняты за метаплазию эпителия. Для того, чтобы правильно оценить площадь измененного эпителия, взять биопсию из всех измененных участков, во время гастроскопии производится окрашивание слизистой (чаще всего метиленовым синим) – краситель хорошо воспринимается участками с кишечной метаплазией.
Специальная гематологическая панель Biohit позволяет быстро и эффективно определить степень метаплазии эпителия, атрофии слизистой и обкладочных желез, избежать ошибок диагностики. В этой панели исследуется уровень сывороточного пепсиногена, определяется соотношение пепсиногена 1 к пепсиногену 2, гистамина 17. Снижение этих показателей говорит о выраженной атрофии клеток железистого эпителия, а низкий уровень гастрина 17 говорит о гибели G-клеток желез желудка.
В то же время, повышение уровня гастрина 17 и пепсиногена 1 часто ассоциируется с хеликобактерной инфекцией. Значительное повышение уровня гастрина 17 чаще всего связано с аутоиммунным гастритом, при котором наблюдается ахлоргидрия или гипохлоргидрия, сохранена функция антрального отдела желудка. Если же в антральном отделе также имеются очаги атрофии (мультифокальная атрофия), то уровни всех этих показателей будут низкими. Данная панель имеет не менее 80% достоверности, используется на начальных этапах обследования и позволяет определиться с типом гастрита, его локализацией и причиной, выявить предраковое состояние и определить правильную тактику лечения.
В сравнении с гематологической панелью и эндоскопическим исследованием с забором биопсии, остальные методы диагностики атрофического гастрита менее информативны. Так, при гастрографии отмечается сглаженность складок слизистой и замедление перистальтики желудка, размеры его уменьшены. Такая же картина обнаруживается при проведении УЗИ желудка. Внутрижелудочная рН-метрия обнаруживает снижение кислотности желудочного сока. Для уточнения диагноза желательно проводить суточное измерение кислотности.
При подозрении на малигнизацию необходимо провести МСКТ органов брюшной полости для исключения опухолевого процесса. Также обязательно проводятся все необходимые исследования для выявления инфицированности H.pylori: ПЦР-диагностику хеликобактер, дыхательный тест, выявление в крови антител к хеликобактер.
Лечение атрофического гастрита
Основной задачей гастроэнтеролога является предупреждение дальнейшей кишечной метаплазии, раковой трансформации. При своевременном начале лечения атрофического гастрита уже через пять лет наступает значительное улучшение состояния эпителия. Обязательно назначается лечебная диета, которая на начальном этапе включает в себя химически, термически и механически щадящую пищу.
После нормализации состояния допускается употребление химически активных продуктов: разведенных соков (лимонный, капустный, клюквенный). Свежие фрукты из диеты исключаются, можно есть только бананы. К пище предъявляются особые требования – она должна быть теплой (нельзя принимать холодные и горячие продукты), приемы пищи должны быть частыми и дробными. Необходимо исключить спиртные напитки и курение.
При обнаружении хеликобактерной инфекции обязательным условием выздоровления является эрадикация инфекционного агента. Современные протоколы лечения предусматривают назначение двух- или трехкомпонентной схемы, включающей антихеликобактерные антибиотики, ингибиторы протонной помпы, препараты висмута. Только полное излечение от хеликобактерий может привести к восстановлению слизистой и снижению риска малигнизации.
Глюкокортикоидные гормоны при атрофическом гастрите назначаются только при развитии В12-фолиеводефицитной анемии. Также назначается симптоматическое лечение: заместительная терапия натуральным желудочным соком, ферментами, недостающими витаминами, препаратами железа. Для стимуляции секреции соляной кислоты необходимо пить минеральные воды с высоким содержанием солей, отвары трав (подорожник, полынь, фенхель), кислые соки, растворы лимонной и янтарной кислот.
Используются гастропротекторы (мизопростол, карбеноксолон), стимуляторы регенерации (облепиховое масло), обволакивающие средства на основе алюминия и висмута, препараты для улучшения перистальтики. Активно применяется физиотерапия: электрофорез с лекарственными препаратами, электро- и магнитотерапия, тепловые процедуры на область эпигастрия. Санаторно-курортное лечение вне периода обострения включает терапию минеральными водами на бальнеологических курортах.
Прогноз и профилактика
Прогноз атрофического гастрита хуже у пациентов возрастной группы старше 50 лет – в этом возрасте метапластические процессы развиваются гораздо быстрее и чаще приводят к малигнизации. Большое значение для полного выздоровления имеет раннее начало лечения, а также степень эрадикации инфекционного агента. Если при повторном обследовании после курса антихеликобактерной терапии в желудочном содержимом определяются микроорганизмы, то курс следует повторить. Профилактикой развития атрофического гастрита является ранняя диагностика и лечение H.pylori, соблюдение режима дня и рационального питания, гигиены рук для предотвращения инфицирования.
Источник