Рибоксин при гастрите атрофическом гастрите
Содержание статьи
Электронный научный журнал
Современные проблемы науки и образования
ISSN 2070-7428
«Перечень» ВАК
ИФ РИНЦ = 0,931
ВЛИЯНИЕ РИБОКСИНА НА СЛИЗИСТУЮ ОБОЛОЧКУ ЖЕЛУДКА ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ХРОНИЧЕСКОМ АТРОФИЧЕСКОМ ГАСТРИТЕ
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Жураковский И.П. 1 Сергеева Я.С. 1 Аутеншлюс А.И. 1
1 ГБОУ ВПО Новосибирский государственный медицинский университет Министерства здравоохранения Российской Федерации
Проведено морфологическое исследование желудка крыс-самцов Wistar после получения модели хронического атрофического гастрита с помощью введения 2 % раствора салицилата натрия в 30 % растворе спирта в течение 8 недель и содержания на альтернативном посту, а также введения раствора рибоксина в дозе 20 мг/кг. Показано, что введение рибоксина приводит к снижению выраженности воспалительного процесса (отсутствует слущивание эпителиальных клеток и расширение венозных сосудов, значительно уменьшается инфильтрация клеточными элементами собственной пластинки слизистой желудка); восстанавливается слизистая оболочка желудка (наблюдается увеличение размеров желез и уменьшение расстояния между ними, снижение выраженности признаков склеротических изменений, приобретение эпителием желез более высокоспециализированного строения, обусловленного восстановлением пула клеток, вырабатывающих желудочный сок и соляную кислоту, и восстановлением до исходного уровня количества клеток, секретирующих кислые муцины).
хронический атрофический гастрит
модель
рибоксин
морфология
1. Effects of He-Ne laser irradiation on chronic atrophic gastritis in rats / X.H. Shao [et al.] // World J. Gastroenterol. — 2005. — Vol. 25, № 11. — P.3958-3961.
2. Gallo Rolanía F.J. Ultrastructural study of the kidney subjected to warm ischemia and perfused with inosine / F.J. Gallo Rolanía, A.J. Álvarez-Morujo Suarez, F.P. Collía Fernandez // Arch. Esp. Urol. — 2013. — Vol. 66, № 10. — P.945-955.
3. Gastric cancer: prevention, screening and early diagnosis / V. Pasechnikov [et al.] // World J. Gastroenterol. — 2014. — Vol. 20. — P.13842-13862.
4. Gastric mucosal atrophy: interobserver consistency using new criteria for classification and grading / M. Rugge [et al.] // Aliment. Pharmacol. Ther. — 2002. — Vol. 16. — P.1249-1259.
5. Haskó G. Trends Immunomodulatory and neuroprotective effects of inosine / G. Haskó, Sitkovsky M.V., Szabó C. // Pharmacol. Sci. — 2004. — Vol. 25, № 3. — P.152-157.
6. Mucin histochemistry of stomach in plasia and adenocarcinoma: An observation / P.K. Mandal [et al.] // Indian J. Med. Paediatr. Oncol. — 2013. — Vol. 34, № 4. — P.229-233.
7. Non-invasive diagnosis of gastric mucosal atrophy in an asymptomatic population with high prevalence of gastric cancer / A. Rollan [et al.] // World J. Gastroenterol. — 2006. — Vol. 12. — P.71-72.
8. Serum gastrin 17, pepsinogen I and pepsinogen II in atrophic gastritis patients living in North-East of Iran / M. Hosseini [et al.] // J. Res. Med. Sci. — 2013. — Vol. 18. — P.225.
9. Siegel R. Cancer istics 2013 / R. Siegel, D. Naishadham, A. Jemal // Cancer J. Clin. — 2013. — Vol. 6. — P.11-30.
Хронический атрофический гастрит (ХАГ), являющийся одним из наиболее распространенных заболеваний органов пищеварения, представляет собой хронический воспалительный процесс, характеризующийся потерей желудочных железистых структур, которые заменяются либо соединительной тканью, либо железистыми структурами, не свойственными для данной локализации [4].
В многочисленных исследованиях показано, что хронический атрофический гастрит является предраковым заболеванием [7;8] и что его лечение имеет важное значение для предотвращения желудочного канцерогенеза [3], приводящего к раку желудка, что является одной из основных причин смертности от онкологических заболеваний во всем мире [9].
Рибоксин (инозин) — относится к группе лекарственных средств, регулирующих метаболические процессы. Этот препарат является предшественником синтеза пуриновых нуклеотидов: аденозинтрифосфата и гуанозинтрифосфата, которые обеспечивают антигипоксический и цитопротекторный эффект [2], что послужило основанием для начала его применения в лечении хронического атрофического гастрита. Вместе с тем механизм влияния рибоксина на данный патологический процесс практически не изучен.
Целью настоящей работы являлось изучение влияния рибоксина на процессы, происходящие в слизистой оболочке желудка при экспериментальном хроническом атрофическом гастрите.
Материал и методы исследования
Эксперимент проведен на 24 половозрелых крысах-самцах Wistar с исходной массой 180-220 г. Для получения модели ХАГ 18-ти экспериментальным животным внутрижелудочно вводили 2 % раствор салицилата натрия в 30 % растворе спирта в течение 8 недель, кроме того, крысы содержались на альтернативном посту (сутки — пост, 2 дня — кормление) со свободным доступом к воде [1]. Экспериментальным животным группы «ХАГ2+Р» в течение третьего месяца внутрижелудочно вводили раствор рибоксина в дозе 20 мг/кг. В качестве контроля использовали интактных животных (группа «Инт»), а также животных, которых не подвергали никакому воздействию в течение 1 месяца после воспроизведения у них модели ХАГ (группа «ХАГ2+1»).
Желудки крыс фиксировали в 12 % формалине. Из залитых в парафин объектов делали серийные срезы толщиной 7 мкм. Морфология слизистой желудка оценивалась при обзорной микроскопии после окраски срезов гематоксилином Эрлиха и эозином. Общий муцин выявляли муцикармином с последующей докраской ядер гематоксилином Эрлиха. Кислые муцины выявляли альциановым синим при рН 1,0 с последующей докраской ядер кармалюмом Майера.
Анализ относительной площади, занимаемой железами желудка, а также клеточных элементов, относительной площади окрашивания общих и кислых муцинов проводился с помощью светооптического микроскопа и морфометрического комплекса на базе микроскопа Micros MC 300A, цифровой камеры CX 13c («Baumer Electric GmbH», Германия) и программного обеспечения ImageJ 1.42g (Национальный институт здоровья, США). Для каждой группы оценивалось по 48 изображений.
Статистическую обработку результатов исследования проводили с использованием программного пакета для статистической обработки SPSS v 13.0 for Windows. Для сравнения независимых групп использовали критерий Крускала — Уоллиса с последующим межгрупповым сравнением с помощью критерия Манна — Уитни. Различия между значениями сравниваемых параметров расценивали как статистически значимые при р< 0,05. Полученные в ходе исследования данные представлены как медиана (Me) и интерквартильный размах (Q1; Q3).
Результаты исследования и обсуждение
При морфологическом исследовании срезов желудка через 2 месяца после начала введения салицилата натрия на фоне содержания животных на альтернативном посту (группа «ХАГ 2») было отмечены признаки, характерные для хронического атрофического гастрита. Так, наблюдалось истончение слизистой оболочки желудка, уменьшение желез в размерах с увеличением расстояния между ними, развитие склеротических изменений (рис. 1), отмечалась инфильтрация слизистой желудка как нейтрофильно-лейкоцитарными, так и макрофагальными элементами (таблица 1). При этом выраженность инфильтрации возросла по сравнению с интактными животными в пилорическом отделе в 16,5 раза, в фундальном — в 6,7 раза. Соотношение клеточных элементов (нейтрофилы, лимфоциты, моноциты/макрофаги, плазматические клетки), образующих инфильтраты в пилорическом отделе, составило 2,7 : 1 : 1,3 : 0,3, в фундальном отделе — 2,5 : 1 : 1 : 0. Исследование срезов пилорического отдела желудка позволило выявить, дополнительно к описанным выше изменениям, наличие очагов кишечной метаплазии с бокаловидными клетками (рис. 2).
Найденные при морфологическом исследовании патологические изменения подобны изменениям, наблюдаемым при хроническом атрофическом гастрите у человека [4], что позволяет сделать заключение о правильности воспроизведения модели.
Таблица 1
Морфометрический анализ клеточных элементов инфильтратов слизистой оболочки желудка в % Me (Q1;Q3)
Показатель | Относительная площадь | |||||
Инфильтратов | Нейтрофилов | Лимфоцитов | Моноцитов | Плазматических клеток | ||
Пилорический отдел | инт | 0,77 (0,19;1,54) # | 0,00 (0,00;0,77) # | 0,00 (0,00;0,77) # | 0,00 (0,00;0,00) # | 0,00 (0,00;0,00) # |
ХАГ2 | 12,69 (10,77;15,19) *# | 6,15 (4,62;7,69) *# | 2,31 (1,54;3,08) *# | 3,08 (2,31;3,85) * | 0,77 (0,00;0,77) *# | |
ХАГ2+1 | 10,77 (10,00;13,08) * | 4,62 (3,85;6,15) * | 2,31 (1,54;2,31) * | 3,08 (2,31;3,85) * | 0,77 (0,77;1,54) * | |
ХАГ2+Р | 8,46 (6,92;9,81) *# | 4,62 (3,85;5,38) * | 1,54 (0,77;1,54) *# | 2,31 (1,54;2,31) *# | 0,00 (0,00;0,77) *# | |
Фундальный отдел | инт | 2,31 (1,54;3,08) # | 0,88 (0,77;1,54) # | 0,77 (0,19;1,54) # | 0,77 (0,00;0,77) # | 0,00 (0,00;0,00) # |
ХАГ2 | 15,38 (13,08;16,73) *# | 7,69 (6,15;8,46) *# | 3,08 (2,50;3,85) *# | 3,08 (2,31;3,85) * | 0,77 (0,77;1,54) *# | |
ХАГ2+1 | 12,31 (10,77;13,65) * | 5,38 (4,62;6,15) * | 3,08 (2,31;3,65) * | 3,08 (2,31;3,08) * | 0,77 (0,00;0,77) * | |
ХАГ2+Р | 9,23 (7,88;10,00) *# | 4,62 (3,85;5,38) *# | 1,54 (1,54;2,31) *# | 2,31 (1,54;3,08) *# | 0,77 (0,00;0,77) * | |
Примечание:
* — достоверные отличия по сравнению с группой Инт при p < 0,05;
# — достоверные отличия по сравнению с группой ХАГ2+1 при p < 0,05.
Отмеченное существенное увеличение общих муцинов, и в частности кислых их фракций, как в фундальном, так и пилорическом отделах желудка (таблица 2), что наблюдается при ХАГ [6] также может служить дополнительным признаком адекватности полученной модели.
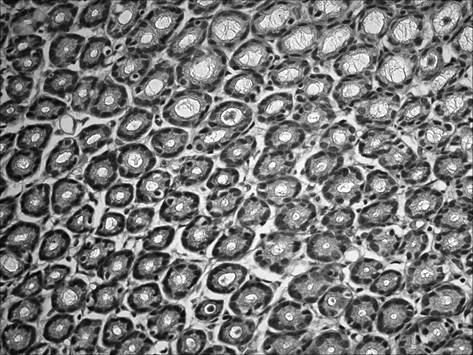
Рис. 1. Слизистая фундального отдела желудка через 2 мес. после начала введения салицилата натрия на фоне содержания животных на альтернативном посту: развитие склеротических изменений. Окр. гематоксилином и эозином, ув. 400
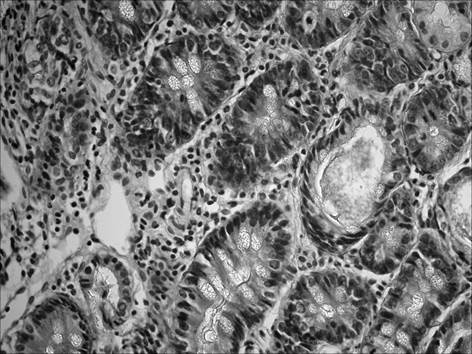
Рис. 2. Слизистая пилорического отдела желудка через 2 мес. после начала введения салицилата натрия на фоне содержания животных на альтернативном посту: наличие очагов кишечной метаплазии с бокаловидными клетками. Окр. гематоксилином и эозином, ув. 400
Таблица 2
Относительная площадь желез, общих и кислых муцинов в % Me (Q1;Q3)
Показатель | Относительная площадь | |||
Желез | Общих муцинов | Кислых муцинов | ||
Пилорический отдел | инт | 70,0 (66,9;71,5)# | 7,5 (5,4;10,7)# | 4,1 (3,1;4,8)# |
ХАГ2 | 13,5 (10,8;16,2) *# | 58,7 (33,2;61,9) *# | 16,5 (13,0;21,1)*# | |
ХАГ2+1 | 31,5 (30,0;33,7) * | 20,4 (18,7;22,8) * | 9,7 (7,3;15,0) * | |
ХАГ2+Р | 47,3 (42,5;49,2) *# | 26,1 (23,0;27,9) *# | 5,0 (3,1;7,3) *# | |
Фундальный отдел | инт | 65,8 (62,3;71,3) *# | 20,7 (18,4;22,9) # | 3,5 (2,4;6,6) # |
ХАГ2 | 27,7 (24,6;35,2) *# | 61,0 (53,3;64,0) *# | 18,0 (14,3;21,1) *# | |
ХАГ2+1 | 43,8 (40,8;47,5) * | 25,0 (22,6;30,8) * | 11,5 (8,2;14,6) * | |
ХАГ2+Р | 50,0 (47,7;51,5) *# | 17,9 (15,2;20,1) *# | 4,1 (2,5;6,6) # | |
Примечание:
* — достоверные отличия по сравнению с группой Инт при p < 0,05;
# — достоверные отличия по сравнению с группой ХАГ2+1 при p < 0,05.
При морфологическом исследовании объектов как фундального, так и пилорического отделов желудка через 1 месяц после окончания введения салицилата натрия на фоне содержания животных на альтернативном посту (группа «ХАГ2+1»), по сравнению с группой «ХАГ2», отмечалось некоторое снижение активности хронического атрофического гастрита. Прежде всего, было отмечено отсутствие фокусов кишечной метаплазии в пилорическом отделе желудка. Кроме того, отмечалось частичное восстановление желез фундального и пилорического отделов желудка, заключающееся как в достоверном увеличении относительной площади самих желез, так и имеющей место тенденции к восстановлению популяций их клеточных элементов, что подтверждалось достоверным уменьшением относительной площади общего и кислых муцинов (таблица 2). Вместе с тем сохранялась признаки склеротических изменений. Выраженность инфильтрации собственной пластинки слизистой желудка, по сравнению с группой «ХАГ2», была достоверно ниже как в пилорическом, так и в фундальном отделах (таблица 1). При этом соотношение клеточных элементов (нейтрофилы, лимфоциты, моноциты/макрофаги, плазматические клетки), образующих инфильтраты в пилорическом отделе, составило 2 : 1 : 1 : 0,33, а в фундальном — 1,75 : 1 : 1 : 0,25.
Данные результаты, вероятно, следует расценивать как подтверждение того, что исключение раздражающего этиологического фактора приводит к некоторому уменьшению воспалительного процесса в слизистой оболочке желудка, однако полного восстановления не происходит, что дает возможность использовать данную модель для изучения длительного приема препаратов.
В отличие от группы «ХАГ2+1», при применении рибоксина (группа «ХАГ 2+Р») отмечалось существенное уменьшение признаков хронического атрофического гастрита. Так, выраженность инфильтрации собственной пластинки слизистой желудка снизилась в пилорическом отделе в 1,5 раза, в фундальном в 1,3 раза (рис. 3). При этом соотношение клеточных элементов (нейтрофилы, лимфоциты, моноциты/макрофаги, плазматические клетки), образующих инфильтраты в пилорическом отделе, составило 3 : 1 : 1,5 : 0, в фундальном отделе — 3 : 1 : 1,5 : 0,5.
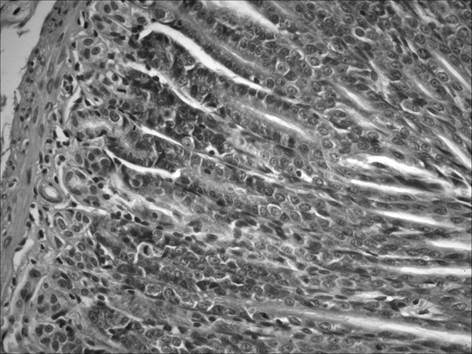
Рис. 3. Слизистая фундального отдела желудка через 1 месяц после окончания введения рибоксина: снижение инфильтрации собственной пластинки нейтрофильно-лейкоцитарными и макрофагальными элементами. Окр. гематоксилином и эозином, ув. 400
Не исключено, что данный эффект рибоксина может быть связан с его способностью влиять на продукцию провоспалительных цитокинов [5]. Кроме того, отмечалось более выраженное, по сравнению с группой «ХАГ2+1», восстановление слизистой оболочки желудка (таблица 2). При применении рибоксина в пилорическом отделе желудка отмечалось достоверное увеличение секреции общего муцина на фоне уменьшения его кислых фракций, а также уменьшение как общего, так и кислых муцинов в фундальном отделе (рис. 4).
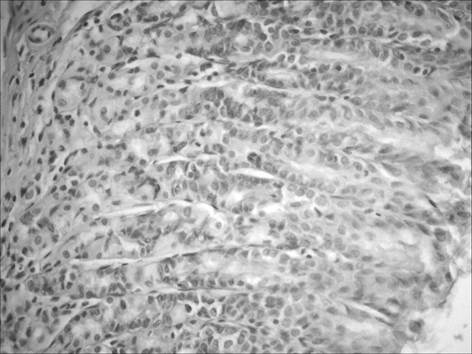
Рис. 4. Слизистая фундального отдела желудка через 1 месяц после окончания введения рибоксина: уменьшение мукоцитов, секретирующих кислый муцин. Окр. альциановым синим при рН=1,0 с последующей докраской ядер кармалюмом Майера, ув. 400
Заключение
Результаты проведенного исследования показали, что применение рибоксина приводит к уменьшению признаков хронического атрофического гастрита, а именно — к снижению выраженности воспалительного компонента ХАГ (отсутствует слущивание эпителиальных клеток и расширение венозных сосудов, значительно уменьшается инфильтрация клеточными элементами собственной пластинки слизистой желудка, преимущественно за счет уменьшения количества лимфоцитов и моноцитов/макрофагов); восстанавливается слизистая оболочка желудка (наблюдается увеличение размеров желез и уменьшение расстояния между ними, снижение выраженности признаков склеротических изменений, приобретение эпителием желез более высокоспециализированного строения, обусловленного восстановлением пула клеток, вырабатывающих желудочный сок и соляную кислоту, и восстановлением до исходного уровня количества клеток, секретирующих кислые муцины).
Библиографическая ссылка
Жураковский И.П., Сергеева Я.С., Аутеншлюс А.И. ВЛИЯНИЕ РИБОКСИНА НА СЛИЗИСТУЮ ОБОЛОЧКУ ЖЕЛУДКА ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ХРОНИЧЕСКОМ АТРОФИЧЕСКОМ ГАСТРИТЕ // Современные проблемы науки и образования. — 2016. — № 4.;
URL: https://science-education.ru/ru/article/view?id=24941 (дата обращения: 20.05.2021).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Атрофический гастрит: прогнозы и перспективы — Eurolab
О.Я. Бабак,
д.м.н., профессор, директор Института терапии им. Л.Т. Малой АМН Украины, г. Харьков
Под атрофическим гастритом понимают прогрессирующий воспалительный процесс слизистой оболочки желудка, характеризующийся утратой желудочных желез. Клинико-морфологической особенностью атрофического гастрита являются уменьшение числа специализированных гландулоцитов, обеспечивающих секреторную функцию желудка, и замещение их клетками более простыми, в том числе вырабатывающими слизь. Обширная атрофия слизистой оболочки тела желудка, как правило, ассоциируется с гипосекрецией соляной кислоты и нарушением выработки пепсиногена.
Что сегодня известно об атрофическом гастрите?
Наиболее частыми этиологическими факторами, вызывающими атрофический гастрит, признаны инфекция Helicobacter Pylori (Н.Pylori) и аутоиммунный гастрит. Причем, с Н. pylori связывают возникновение подавляющего большинства атрофических гастритов. Бактерии Н. рylori, персистируя на желудочном эпителии, вызывают хронический хеликобактерный поверхностный гастрит. Длительно существующий поверхностный хеликобактерный гастрит без соответствующего лечения трансформируется в атрофический.
Атрофический гастрит клинически, как правило, в течение длительного времени ничем себя не проявляет, поэтому диагноз хронического гастрита, скорее, морфологический, нежели клинический. Основным методом диагностики атрофического гастрита является эндоскопическое исследование. При эндоскопии производят осмотр пищевода, желудка, двенадцатиперстной кишки. При выраженной атрофии слизистая оболочка желудка имеет характерные отличия в сравнении с таковой при, например, поверхностном гастрите.
Окончательный диагноз позволяет установить морфологический анализ биоптатов слизистой оболочки желудка, взятых во время эндоскопии. Морфологически атрофия определяется уменьшением числа функционирующих специализированных клеток желудка. Доказано, что при Н. pylori-ассоциированном гастрите процессы атрофии чаще возникают при инфицировании определенными штаммами (Cag A+ и Vac A+) Н. pylori. Одним из морфологических признаков атрофического гастрита является кишечная метаплазия, которая традиционно рассматривалась как предраковое изменение слизистой оболочки желудка.
Другие методы исследования — рентгенография желудка, ультразвуковое исследование брюшной полости и компьютерная томография — в плане диагностики атрофического гастрита неинформативны.
Чего нужно опасаться при атрофическом гастрите? Каков прогноз болезни?
Гипотетически наличие атрофического гастрита при естественном течении может иметь два сценария. Первый — длительно существующий хронический гастрит приводит к значительному уменьшению кислотообразующей функции желудка, требующему заместительной терапии, без которой будут наблюдаться признаки нарушения пищеварительной функции. Второй вариант — в результате длительного хронического персистирующего воспаления в слизистой оболочке желудка, характерного для Н. pylori-ассоциированного гастрита, происходит нарушение клеточного обновления в желудке, что способствует появлению клеток-мишеней для влияния на них канцерогенных веществ, в дальнейшем — к клеточным мутациям. В результате нормальный клеточный эпителий желудка замещается метапластическим, диспластическим и неопластическим.
По определению ВОЗ, под дисплазией понимают такие клеточные изменения, при которых часть эпителия замещена клетками с различной степенью атипии. В международной классификации эпителиальных неоплазий пищеварительного тракта (2000) дисплазия — это неоплазия, другими словами — опухоль. Итак, атрофический гастрит может трансформироваться в рак желудка. Наибольшую опасность в плане развития рака представляет атрофический гастрит с пониженной кислотообразующей функцией желудка (частота возникновения рака — до 13%). Среди известных в настоящее время молекулярных механизмов, лежащих в основе наследственной предрасположенности к раку желудка, выделены: индукция экспрессии TGF-β1, частичный полиморфизм кластера гена IL-1 (IL-1β). В результате развития атрофии слизистой оболочки желудка снижается ее противоопухолевая защита, создаются условия для активного воздействия канцерогенов. При возникновении тяжелой атрофии эпителия тела желудка риск развития рака желудка повышается в 5 раз в сравнении с таковым при неатрофическом гастрите.
Бактерии Н. pylori относят к биологическим канцерогенам в отношении рака желудка. Большинство исследователей считают, что Н. pylori — это основной этиологический фактор развития хронического гастрита, который является обязательным звеном в каскаде процессов, приводящих к раку желудка. На основании анализа результатов многоцентровых исследований Международное агенство по изучению рака при ВОЗ еще в 1994 году рекомендовало считать инфекцию Н. pylori абсолютным канцерогеном для человека.
В настоящее время рак желудка рассматривается как конечный результат длительного многоступенчатого и многофакторного процесса, в котором клеточные изменения слизистой оболочки желудка обусловлены нарушениями микроокружения. Этот процесс называют именем описавшего его автора — каскадом Корреа (1995). Он включает хронический гастрит, кишечную метаплазию, дисплазию и рак. Н. рylori-ассоциированный желудочный канцерогенез — многоэтапный процесс, характеризующийся развитием хронического гастрита — первой ступени в эволюционном каскаде. Последующие изменения приводят к формированию атрофии, тонкокишечной (I и II типы) и толстокишечной (III тип) метаплазий и дисплазии желудочного эпителия, в итоге — к аденокарциноме желудка. Именно атрофический гастрит занимает срединное положение в цепи вышеперечисленных изменений на пути к раку желудка.
Как избежать трансформации атрофического гастрита в рак желудка?
Ответ на данный вопрос состоит из равных по значимости частей: как можно раннее выявление предраковых изменений, их адекватное лечение и предупреждение (профилактика) проявления последних. При наблюдении больных хроническим гастритом важно уловить тот момент, когда возникает и начинает прогрессировать атрофия слизистой оболочки желудка, причем желательно это проводить простым информативным и неинвазивным способом.
Своевременное выявление атрофии слизистой оболочки желудка — первый диагностический этап выявления риска по раку желудка.
Многочисленные исследования последних лет показали, что очаги полной и неполной кишечной метаплазии слизистой оболочки желудка нельзя расценивать в качестве достоверного маркера повышенного риска развития рака желудка. Исследования свидетельствуют, что значительно важнее оценка не типа метаплазии, а ее объема. Так, при большом объеме метаплазии, превышающем 20% поверхности желудочного эпителия, создаются реальные условия для развития дисплазии с последующим образованием аденокарциномы желудка. Следовательно, риск развития рака желудка повышается при тяжелой атрофии желудочного эпителия, характеризующейся обширными очагами кишечной метаплазии.
Как же на практике определить площадь такого поражения? Следует помнить, что данные изменения происходят на клеточном уровне, и при обычной эндоскопии их распознать невозможно. Доступным и эффективным способом диагностики метапластических изменений в слизистой оболочке желудка является метод хромогастроскопии — прижизненная окраска слизистой желудка красителем (чаще метиленовым синим), проводимая во время эндоскопического исследования. Данная методика основана на поглощении красителя очагами кишечной метаплазии, что позволяет оценить их размеры, выполнить прицельную биопсию для гистологического анализа биоптата слизистой и выявить возможную дисплазию или метаплазию.
Вместе с тем морфологическая диагностика атрофического гастрита сопряжена с рядом трудностей. Сложность постановки диагноза атрофии морфологическим методом обусловлена тем, что на ранних стадиях процесс никогда не бывает диффузным, следовательно, результаты гастробиопсии могут способствовать гипер- и гиподиагностике. При воспалении может изменяться микроскопическая картина и неадекватно оцениваться проявления атрофического гастрита из-за ложного вывода о потере желез. Высока и субъективность методики. Все это заставляет искать другие надежные пути тестирования атрофических изменений слизистой оболочки желудка.
Разработан ряд малоинвазивных гематологических тестов (тестовая панель Biohit), позволяющих избежать ошибок диагностики, дать совокупную оценку состояния слизистой оболочки желудка, степени ее атрофии и потери нормальных желез и клеток в антральном отделе и теле желудка.
Во время проведения эндоскопического исследования обязательно должна проводиться детекция на наличие Н. pylori. При этом наиболее целесообразным следует признать уреазный или гистологический методы (из гастробиоптатов) исследования.
Определение уровня сывороточного пепсиногена (S-PGІ) или соотношения содержания пепсиногена I к пепсиногену II (PGI/PGII) — неэндоскопический метод диагностики атрофического гастрита с поражением тела желудка. С увеличением степени атрофии слизистой оболочки тела желудка (потеря нормальных кислотообразующих желез) уровни S-PGI и PGI/PGII постепенно снижаются. Определение уровня гастрина в сыворотке крови, преимущественно гастрина-17 (S-G-17), может быть использовано в качестве индикатора морфологического состояния слизистой оболочки антрального отдела желудка. То есть снижение S-G-17 является биохимическим маркером атрофического гастрита с поражением антрального отдела желудка (потеря антральных G-клеток).
Снижение уровней S-G-17 и S-PGI можно рассматривать как результат прогрессирующего атрофического гастрита с потерей нормальных желез и клеток слизитой оболочки тела и антрального отдела желудка. G-17 практически полностью синтезируются и секретируются G-клетками антрального отдела желудка. Эти клетки являются компонентами нормальных антральных желез, в случае прогрессирования атрофического гастрита их количество уменьшается на фоне поражения антральных желез и появления кишечной метаплазии. При Н. pylori-ассоциированном гастрите имеется тенденция к возрастанию серологических уровней G-17 и PGI. Низкая внутрижелудочная кислотность способствует увеличению серологического уровня G-17, и наоборот.
Перманентная длительная гипо- или ахлоргидрия приводят к чрезвычайно высоким уровням G-17 в крови. Особенно часто это наблюдается при пониженной кислотности (атрофический гастрит с поражением тела желудка) в сочетании с сохраненной слизистой оболочкой антрального отдела. Такая клиническая картина наиболее характерна для аутоиммунного атрофического гастрита. Если в антральном отделе имеются сопутствующие признаки атрофии слизистой оболочки (мультифокальный атрофический гастрит), тогда содержание S-G-17 не возрастает, и тестовая панель показывает низкие значения уровней S-PGI и S-G-17.
Совокупная точность тестовой панели в диагностике атрофического гастрита — около 80% (при сопоставлении с результатами эндоскопии и биопсии). Данная тестовая панель является малоинвазивной альтернативой первоначального обследования пациентов с подозрением на желудочную атрофию и дисплазию. Она позволяет надежно выявлять пациентов с различными формами гастрита, определять локализацию и этиологию патологического процесса, оценивать вероятность развития рака желудка и выстраивать дальнейшую тактику ведения больного.
Учитывая связь возникновения атрофии желудочного эпителия и кишечной метаплазии с инфекцией Н. pylori, становится очевидным выбор метода лечения и профилактики дальнейшего прогрессирования процесса. Методом выбора является антихеликобактерная терапия.
В 2002 году японские исследователи убедительно доказали возможность регрессии метапластических изменений слизистой оболочки желудка после успешного уничтожения бактерий Н. pylori. С помощью хромоскопии им удалось установить, что в течение пяти лет после проведения успешной антихеликобактерной терапии размеры очагов кишечной метаплазии уменьшились почти в 2 раза в сравнении с исходными. В последующих исследованиях подтвердилась целесообразность такого терапевтического подхода.
В настоящее время не вызывает сомнений необходимость проведения антихеликобактерной терапии пациентам с атрофическим гастритом. Предварительные данные нескольких многоцентровых исследований по мониторингу Н. pylori-ассоциированного предрака и рака желудка свидетельствуют в пользу реверсии воспаления слизистой оболочки желудка и связанных с ней атрофии, кишечной метаплазии и генетической нестабильности. В связи с этим в идеале пациентам с Н. pylori-позитивным хроническим атрофическим гастритом необходимо проводить эрадикационную терапию, а при отсутствии эффекта — исследование с целью выявления маркеров генетической нестабильности и тщательный мониторинг.
Данная рекомендация нашла отражение в международных рекомендациях по диагностике и лечению заболеваний, ассоциированных с Н. pylori — Маастрихтском консенсусе 3 (2005). Для уничтожения бактерий Н. pylori, как и в Маастрихтском консенсусе 2 (2000), рекомендованы трех- и четырехкомпонентные схемы антибактериальных препаратов в сочетании с ингибиторами протонной помпы (ИПП) в стандартных дозах: ИПП + кларитромицин + амоксициллин и ИПП + тетрациклин + метронидазол (фуразолидон) + коллоидный висмут.
Вместе с тем следует помнить, что полное восстановление структуры слизистой оболочки при тяжелой атрофии до нормы требует длительного времени, и в ряде случаев, по всей видимости, это не возможно. В случаях, когда предопухолевые процессы не подвергаются обратному развитию либо прогрессируют, необходимо применять более радикальные методы лечения, используя арсенал современных эндоскопических операций, вплоть до резекции слизистой оболочки желудка.
Главная цель первичной профилактики атрофического гастрита — своевременное и эффективное лечение поверхностного хеликобактерного гастрита. Для этого используют стандартные схемы антихеликобактерной терапии, в соответствии с рекомендациями Маастрихтских консенсусов 2 (2000) и 3 (2005). Важным моментом является последующий контроль за успешностью этой терапии. Контроль необходимо проводить с использованием неинвазивных методов (дыхательного уреазного или стул-теста). При неудачной эрадикации проводить повторные курсы лечения.
Кроме того, доказано, что, придерживаясь здорового режима питания, можно снизить онкологический риск (прогрессирование атрофии), что подтверждено в исследованиях, проведенных в ряде стран. Рекомендуется избегать употребления консервированных, маринованных и копченых продуктов, отказаться от курения и употребления крепких спиртных напитков (особенно в сочетании с жирной, жареной, копченой и соленой пищей), исключить переедание. Необходимо контролировать массу тела, выполнять активные физические нагрузки, употреблять больше свежих овощей (в том числе лук и чеснок), фруктов и натуральных соков, витаминов А, С, b-каротина, зелени, круп грубого помола, молочных продуктов. В некоторых развитых странах Европы и США внедрение здорового образа жизни привело к снижению заболеваемости раком желудка в несколько раз, сегодня это заболевание в этих странах считается редким, составляя лишь 3% среди злокачественных новообразований. Мониторирование — постоянное наблюдение с периодическим повторным обследованием — абсолютно обязательно для пациентов с атрофическим гастритом
Итак, в настоящее время очевидна необходимость особого внимания к атрофическому гастриту. Комплексное применение современных методов исследования — эндоскопического, морфологического, гематологического (тестовой панели) и других — способствует его точной диагностике. Использование эффективных методов лечения и профилактики атрофического гастрита, устранение условий, которые способствуют его развитию, представляют сегодня реальную возможность улучшить прогноз этого заболевания, устранить риск развития рака желудка.
Литература
1. Е.Г. Бурдина, Е.М. Майорова, Е.В. Григорьева, И.И.Тимофеева, О.Н. Минушкин // Гастрин-17 и пепсиноген І в оценке состояния слизистой оболочки желудка // Российский медицинский журнал, 2006, №2, с. 9-11.
2. Х. Ваананен, М. Ваухконен, Т. Хэлске, И. Каариянен, М. Расмуссен, Х. Тунтури-Хихнала, Дж. Коскенпато, М. Сотка, М. Турунен, Р. Сандстрем, М.Ристиканкаре, А. Юссила, П. Сиппонен // Неэндоскопическая диагностика атрофического гастрита на основании анализа крови: корреляция между результатами гистологического исследования желудка и уровнями гастрина-17 и пепсиногена І в сыворотке // Клинические перспективы гастроэнтерологии, гепатологии, 2003, № 4, с. 26-32.
3. В.Д. Пасечников, С.З. Чуков, С.М. Котелевец / Профилактика рака желудка на основе эрадикационной терапии предопухолевых заболеваний // Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 2003, № 4, с. 11-19.
4. А.А. Шептулин, В.А. Киприанис / Диагностика и лечение инфекции Helicobacter pylori: основные положения согласительного совещания «Маастрихт — 3» // Российский журнал гастроэнтерологии гепатологии колопроктологии, 2006, № 2, с. 88-91.
5. Kim N., Lim S. H., Lee K.H. et al. Long-term effects of Helicobacter pylori eradication on intestinal plasia in patients with duodenal and behign gastric ulcers Dig. Dis. Sci. — 2000. — Vol. 45. — 1754-1762.
6. Malfertheiner P., Megraud F., O’Morain C. еt al. Current concepts in the management of Helicobacter pylori infection — The Maastricht 2 Concensus Report // Aliment. Pharmacol. Ther. — 2002. — Vol. 16. — P. 167-180.
Источник