Патогенез хронического гастрита хеликобактер
Содержание статьи
Механизм развития (патогенез) связанного с хеликобактер гастрита
В отличие от острого гастрита симптомы хронического гастрита обычно менее выражены, но более постоянны. Могут возникать тошнота и дискомфорт в верхних отделах живота, иногда сопровождающиеся рвотой, но кровавая рвота нехарактерна. Самой частой причиной развития хронического гастрита является инфицирование H. pylori. До того как была признана главная роль H. pylori, первопричиной хронического гастрита считали другие постоянные раздражители, включая психологический стресс, кофеин, употребление алкоголя и курение.
Аутоиммунный гастрит (самая частая причина развития атрофического гастрита) составляет менее 10% всех наблюдений хронического гастрита и является наиболее частой формой хронического гастрита среди пациентов без инфекции H. pylori. Реже хронический гастрит индуцируется лучевой терапией, хроническим рефлюксом желчи, механической травмой или системными заболеваниями, например болезнью Крона, амилоидозом, болезнью «трансплантат против хозяина».
Открытие H. pylori произвело революцию в нашем понимании хронического гастрита. Эти спиралевидные или изогнутые микроорганизмы выявляют в биоптатах желудка практически у всех пациентов с язвой двенадцатиперстной кишки и у большинства лиц с язвой желудка или хроническим гастритом. В своем знаменитом эксперименте лауреат Нобелевской премии Барри Маршалл выпил раствор, содержащий H. pylori, и спровоцировал у себя слабовыраженный гастрит. Именно такой, не совсем правильный и безопасный способ изучения инфекционных заболеваний показал патогенность H. pylori.
Острая инфекция H. pylori в большинстве случаев не сопровождается какими-либо заметными симптомами, и медицинская помощь не нужна, однако хронический гастрит в конечном итоге заставляет пациента обратиться к врачу. H. pylori обнаруживают у 90% лиц с хроническим гастритом, преимущественно антральным. H. pylori играет важную роль в развитии других заболеваний желудка и двенадцатиперстной кишки.
Например, повышение секреции соляной кислоты, которое происходит при хеликобактер-ассоциированном гастрите, может стать причиной язвенной болезни. Кроме того, инфекция H. pylori повышает риск развития рака желудка.
а) Эпидемиология. В США к рискам инфицирования H. pylori относят бедность, перенаселение, этническую принадлежность (представители негроидной расы и потомки коренных жителей Мексики имеют повышенный риск), низкий уровень образования, проживание в сельской местности и рождение за пределами США. Во всем мире уровень колонизации H. pylori варьирует от 10 до 80%. В областях с высоким уровнем колонизации H. pylori инфицирование происходит еще в детском возрасте, затем инфекция персистирует в течение десятилетий.
Способ передачи H. pylori точно не определен, но поскольку люди являются единственными известными резервуарами инфекции, наиболее вероятными путями ее передачи служат орально-оральный, фекально-оральный и бытовой. Сходный микроорганизм H. heilmannii вызывает аналогичное заболевание, но его резервуарами являются кошки, собаки, свиньи и приматы. Морфологически H. pylori и H. heilmannii едва различимы, однако идентификация инфекции H. heilmannii важна, т.к. указывает на необходимость лечения домашних животных с целью предотвращения реинфицирования хозяина животного.
б) Патогенез. Инфекция H. pylori — самая частая причина развития хронического гастрита. Заболевание в основном проявляется в форме антрального гастрита с гиперсекрецией соляной кислоты в условиях гипогастринемии. У таких пациентов повышен риск развития язвы двенадцатиперстной кишки, а кардиальный отдел вовлекается в процесс очень редко. У многих пациентов гастрит прогрессирует и вовлекает тело и дно желудка (пангастрит).
H. pylori адаптировалась к существованию в особой экологической нише, представленной слизью на поверхности желудочного эпителия. Хотя H. pylori может внедряться в слизистую оболочку желудка, это не выявляется при гистологическом исследовании, поэтому роль такой инвазии в развитии заболевания неизвестна.
Существуют 4 фактора, обеспечивающие вирулентность H. pylori:
— жгутик, позволяющий бактерии двигаться в густой слизи;
— уреаза, образующая аммиак из эндогенной мочевины и таким образом повышающая в желудке уровень pH локально;
— адгезины, усиливающие прилипание бактерии к поверхности фовеолярных клеток;
— цитотоксип-ассоциированный ген А (CagA), который может быть вовлечен в развитие язвы или рака (этот механизм не до конца изучен).
Механизмы, посредством которых H. pylori вызывает гастрит, определены не полностью, однако известно, что инфицирование приводит к увеличению секреции соляной кислоты и нарушению нормальных защитных механизмов в желудке и двенадцатиперстной кишке. Таким образом, хеликобактер-ассоциированный гастрит является результатом нарушения баланса между факторами защиты слизистой оболочки желудка и двенадцатиперстной кишки и повреждающими эту защиту факторами.
Со временем хронический хеликобактер-ассоциированный антральный гастрит прогрессирует до пангастрита, который сопровождается мультифокальной атрофией слизистой оболочки (мультифокальный атрофический гастрит), снижением секреции соляной кислоты, кишечной метаплазией и повышенным риском развития аденокарциномы желудка. Механизмы, лежащие в основе этого процесса, неизвестны, но решающую роль, вероятно, играют взаимодействия между организмом-хозяином и бактерией.
Например, некоторые типы полиморфизмов гена, кодирующего синтез провоспалительного цитокина IL-1b, коррелируют с развитием пангастрита после инфицирования H. pylori. Полиморфизм гена TNF и ряда других генов, связанных с воспалительным ответом, также влияет на исход инфекции H.pylori. Тяжесть заболевания может быть обусловлена генетическими особенностями штаммов H. pylori. Например, ген CagA (маркер патогенности) определяется в 50% всех штаммов H. pylori и в 90% штаммов этого микроорганизма, выделенных в популяциях с высоким риском развития рака желудка.

в) Морфология. В биоптатах слизистой желудка инфицированных пациентов обычно определяется H. pylori. Микроорганизмы концентрируются в поверхностном слое слизи, покрывающей эпителиальные клетки и шеечную часть желез. Распределение H. pylori может быть неравномерным, участки массивной колонизации могут граничить с областями, где присутствуют одиночные микроорганизмы. В тяжелых случаях бактерии полностью покрывают всю люминальную поверхность фовеолярных и шеечных клеток и даже могут проникать в желудочные ямки. Микроорганизмы лучше выявляются с помощью специального окрашивания.
H. pylori обладает тропизмом к эпителию желудка и обычно не обнаруживается в участках кишечной метаплазии слизистой оболочки желудка и в двенадцатиперстной кишке. Однако H. pylori можно обнаружить в участках пилорической метаплазии хронически поврежденной слизистой оболочки двенадцатиперстной кишки или в слизистой оболочке желудочного типа при пищеводе Барретта.
Обычно H. pylori выявляют в антральном отделе желудка. Кардиальный отдел, несмотря на четкую взаимосвязь между колонизацией его и антрального отдела, поражается достаточно редко. Наличие H. pylori нехарактерно для кислотопродуцирующей слизистой оболочки дна и тела желудка, за исключением случаев массивной колонизации. Таким образом, для диагностики хеликобактер-ассоциированного гастрита предпочтительна биопсия из антрального отдела желудка. При эндоскопическом исследовании слизистая оболочка антрального отдела, инфицированная H. pylori, обычно гиперемирована и имеет крупнозернистый или узелковый вид.
Воспалительный инфильтрат, как правило, характеризуется различным количеством нейтрофилов в собственной пластинке слизистой оболочки желудка, включая те, которые проникают через базальную мембрану и становятся внутриэпителиальными, а также попадают в просвет желудочных ямок, формируя в них абсцессы. В дополнение к этому в поверхностных отделах собственной пластинки определяется большое количество плазматических клеток, часто в виде скоплений или пластов, атакже многочисленные лимфоциты и макрофаги. Внутриэпителиальные нейтрофилы и субэпителиальные плазматические клетки являются характерным признаком хеликобактер-ассоциированного гастрита.
Активный воспалительный процесс может привести к утолщению желудочных складок, внешне похожему на раннее инфильтративное образование. Длительно существующий хеликобактер-ассоциированный гастрит может распространиться на тело и дно желудка, а слизистая оболочка может стать атрофичной. Часто присутствуют лимфоидные скопления, иногда содержащие герминативные центры, и могут представлять собой лимфоидную ткань, ассоциированную со слизистыми оболочками, которая может трансформироваться в MALT-лимфому.
г) Клинические признаки. Помимо гистологического исследования существуют и другие диагностические методы, позволяющие обнаружить микроорганизмы: неинвазивный серологический тест на определение антител к H. pylori, анализ кала; уреазный дыхательный тест, основанный на способности бактериальной уреазы образовывать аммиак. При исследовании биопсийного материала слизистой оболочки желудка проводят быстрый уреазный тест или бактериальный посев, а с помощью ПЦР выделяют бактериальную ДНК.
Эффективным способом лечения инфекции H. pylori является комбинированное применение антибиотиков и препаратов из группы ингибиторов протонной помпы. Пациенты с хеликобактер-ассоциированным гастритом после такой терапии обычно выздоравливают, однако в случае неполной эрадикации возбудителя или реинфицирования может произойти рецидив заболевания. Разработка вакцины для профилактики и лечения инфекции H. pylori все еще находится на ранних этапах исследования. Язвенная болезнь, являющаяся осложнением хронического хеликобактерассоциированного гастрита, описана далее.

Хеликобактер-ассоциированный гастрит:
(А) Спиралевидные Helicobacter pylori хорошо видны при импрегнации серебром по методу Уортина-Старри.
В поверхностном слое слизи определяется большое количество микроорганизмов.
(Б) Многочисленные внутриэпителиальные нейтрофилы, а также нейтрофилы в области собственной пластинки слизистой оболочки желудка.
(В) Лимфоидные скопления с герминативными центрами,
а также многочисленные субэпителиальные плазматические клетки в поверхностных отделах собственной пластинки слизистой оболочки желудка являются характерным признаком хеликобактер-ассоциированного гастрита.
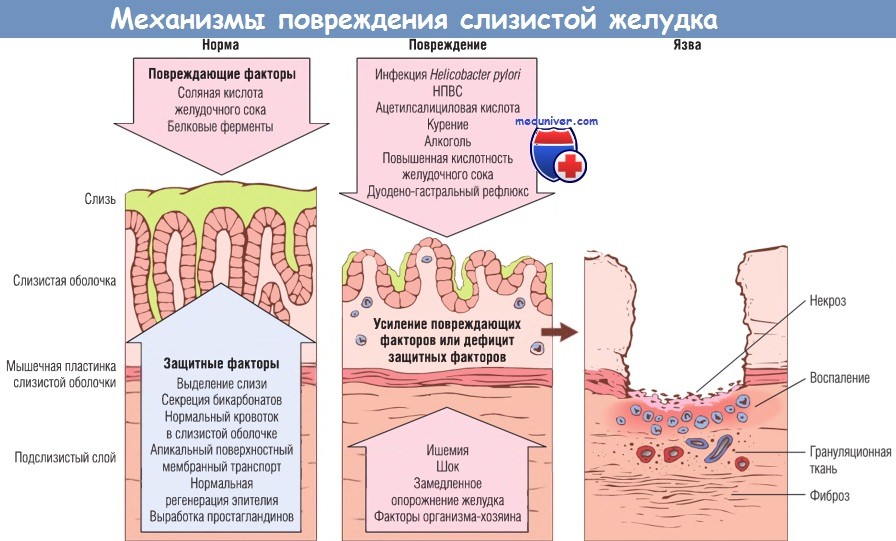
Механизмы повреждения (от легких форм к изъязвлению, которое может осложнить острый или хронический гастрит) и защиты слизистой оболочки желудка.
Дно язвенного дефекта представлено слоями некротизированных клеток, воспалительных клеток, грануляционной ткани и фиброзной ткани.
Фиброз, для развития которого нужно определенное время, наблюдается только при хронических поражениях.
НПВС — нестероидные противовоспалительные средства.
— Рекомендуем ознакомиться со следующей статьей «Механизм развития (патогенез) аутоиммунного гастрита»
Оглавление темы «Патогенез болезней пищевода и желудка»:
- Механизм развития (патогенез) аденокарциномы пищевода
- Механизм развития (патогенез) плоскоклеточного рака пищевода
- Механизм развития (патогенез) доброкачественной опухоли пищевода
- Механизм развития (патогенез) острого гастрита
- Механизм развития (патогенез) острой язвы желудка
- Механизм развития (патогенез) связанного с хеликобактер гастрита
- Механизм развития (патогенез) аутоиммунного гастрита
- Механизм развития (патогенез) редких форм хронического гастрита
- Механизм развития (патогенез) язвенной болезни
- Механизм развития (патогенез) атрофии и дисплазии слизистой желудка
Источник
Хронический гастрит, вызванный Helicobacter pylori
Медицинский эксперт статьи
х
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Helicobacter pylori (хеликобактер пилори) является основным патогенным микроорганизмом желудка, вызывающим гастрит, язвенную болезнь, аденокарциному желудка и низкодифференцированную лимфому желудка.
Хронический гастрит, вызванный Helicobacter pylori может протекать бессимптомно или вызывать различной степени тяжести диспепсию. Диагноз устанавливается дыхательным тестом с мочевиной, меченной С14 или С13, и морфологическими исследованиями биоптатов при эндоскопии. Лечение хронического гастрита, вызванного Helicobacter pylori заключается в применении ингибиторов протонной помпы и двух антибиотиков.
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11], [12], [13]
Чем вызывается хронический гастрит, вызванный Helicobacter pylori?
Helicobacter pylori представляет собой спиралевидный, грамотрицательный микроорганизм, который приспособился к размножению в кислой среде. В развивающихся странах он является причиной хронических инфекций и обычно приобретается в детстве. В США инфекция менее характерна для детей, но заболеваемость увеличивается с возрастом: приблизительно 50 % людей в возрасте 60 лет инфицированы. Инфекция особенно распространена у афроамериканцев и испаноговорящих.
Микроб был высеян из стула, слюны и зубного налета, что предполагает оро-оральную или фекально-оральную передачу инфекции. Инфекция имеет тенденцию распространяться в семьях и у жителей приютов. Медсестры и гастроэнтерологи оказываются в группе высокого риска: бактерии могут передаваться через недостаточно дезинфицированные эндоскопы.
Патофизиология хронического гастрита, вызванного Helicobacter pylori
Влияние инфекции Helicobacter pylori (хеликобактер пилори) изменяется в зависимости от локализации в пределах желудка. Преобладание инфекции в антральном отделе желудка приводит к повышению секреции гастрина, скорее всего из-за локального снижения синтеза соматостатина. Возникающая гиперсекреция соляной кислоты предрасполагает к развитию препилорической и дуоденальной язвы. Инфекция, преобладающая в теле, приводит к атрофии слизистой желудка и снижению продукции кислоты, возможно из-за увеличения локальной секреции интерлейкина 1b. Пациенты с преобладанием инфекции в теле предрасположены к язве желудка и аденокарциноме. Некоторые пациенты имеют комбинированную инфекцию антрального отдела и тела желудка с сочетанными клиническими проявлениями. У многих пациентов с инфекцией Helicobacter pylori не развивается никаких значимых клинических проявлений.
Аммиак, вырабатываемый Helicobacter pylori, позволяет организму выжить в окружающей его кислой среде желудка и разрушить слизистый барьер. Цитотоксины и муколитические ферменты (напр., бактериальная протеаза, липаза), вырабатываемые Helicobacter pylori, могут играть роль в повреждении слизистой оболочки и последующем ульцерогенезе.
Инфицированные люди в 3-6 раз чаще болеют раком желудка. Инфекция Helicobacter pylori ассоциируется с интестинальным типом аденокарциномы тела и антрального отдела желудка, но не раком кардиального отдела. Другие ассоциированные злокачественные опухоли включают лимфому желудка и ассоциированную со слизистыми оболочками лимфоидную ткань (MALT-лимфома), моноклональную ограниченную опухоль В-клеток.
Диагностика хронического гастрита, вызванного Helicobacter pylori
Скрининговое обследование асимптоматических пациентов не гарантирует установления диагноза. Исследования выполняются для оценки течения пептической язвы и гастрита. Обычно выполняется также обследование после лечения для подтверждения гибели микроорганизма. Дифференцированные исследования проводятся для верификации диагноза и эффективности лечения.
[14], [15], [16], [17], [18], [19]
Неинвазивные тесты на хеликобактер
Лабораторные анализы на хеликобактер и программированные серологические тесты антител к Helicobacter pylori имеют чувствительность и специфичность более 85% и считаются неинвазивными тестами выбора при первичной верификации инфекции Helicobacter pylori (хеликобактер пилори). Однако, так как качественное определение остается позитивным до 3 лет после успешной терапии и количественные уровни антител значительно не снижаются в течение 6-12 месяцев после лечения, серологические исследования для оценки эффективности лечения обычно не используются.
При определении мочевины в выдыхаемом воздухе используют 13С или 14С меченую мочевину. У инфицированного пациента организм метаболизирует мочевину и выделяет меченый СО2, который выдыхается и может быть определен количественно в выдыхаемом воздухе через 20-30 минут после перорального приема меченой мочевины. Чувствительность и специфичность метода составляет более 90%. Дыхательный тест на хеликобактер (на мочевину) хорошо подходит для подтверждения гибели микроорганизма после лечения. Ложноотрицательные результаты возможны при предшествующем применении антибиотиков или ингибиторов протонной помпы; поэтому последующие исследования должны проводиться спустя более 4 недель после антибактериальной терапии и 1 недели после терапии ингибиторами протонной помпы. Н2-блокаторы не влияют на результаты теста.
Инвазивные тесты на хеликобактер
Гастроскопия применяется для биопсийного забора фрагментов слизистой оболочки с целью выполнения быстрого теста на мочевину (БТМ или уреазный тест) и гистологической окраски биоптата. Бактериальный посев имеет ограниченное использование из-за низкой устойчивости микроорганизма.
Быстрый тест на мочевину, при котором присутствие бактериальной мочевины в биоптатах вызывает изменение окрашивания в специальных средах, является методом выбора диагностики образцов ткани. Гистологическое окрашивание биоптатов должно быть выполнено пациентам с отрицательными результатами БТМ, но при клиническом подозрении на инфекцию, а также при ранее проведенной терапии антибиотиками или лечении препаратами ингибиторами протонной помпы. Быстрый тест на мочевину и гистологическое окрашивание имеют чувствительность и специфичность более 90%.
Лечение хронического гастрита, вызванного Helicobacter pylori
Пациентам с осложнениями (напр., гастритом, язвой, малигнизацией) необходимо назначение лечения, направленного на уничтожение микроорганизма. Уничтожение Helicobacter pylori может даже в некоторых случаях привести к излечению лимфомы из слизисто-ассоциированной лимфоидной ткани (но не другого злокачественного процесса, связанного с инфекцией). Лечение бессимптомно протекающей инфекции является спорным, но признание роли Helicobacter pylori в развитии рака привело к рекомендации превентивного лечения.
Лечение хронического гастрита, вызванного Helicobacter pylori (хеликобактер пилори) требует применения смешанной терапии, обычно включающей антибиотики и средства, подавляющие кислотность. Ингибиторы протонной помпы подавляют Н. pylori и повышают рН желудка, увеличивая концентрацию медикамента в тканях и эффективность антибактериальных препаратов, создавая неблагоприятную среду для Н. pylori.
Рекомендуется применение трех препаратов. Пероральный прием омепразола по 20 мг 2 раза в день или ланзопразола по 30 мг 2 раза в день, кларитромицина по 500 мг 2 раза в день и метронидазола по 500 мг 2 раза в день или амоксициллина 1 г 2 раза в день в течение 14 дней излечивают инфекцию более чем в 95% случаев. Этот режим имеет превосходную толерантность. Ранитидин висмута цитрат по 400 мг перорально 2 раза в день можно использовать в качестве блокатора Н2-гистаминовых рецепторов для повышения рН.
Терапия четырьмя препаратами с ингибитором протонной помпы 2 раза в день, тетрациклин 500 мг и основной салициловокислый или цитрат висмута 525 мг 4 раза в день и метронидазол 500 мг 3 раза в день также эффективна, но более громоздка.
Инфицированные пациенты с дуоденальной или желудочной язвой нуждаются в пролонгированном подавлении кислотности, по крайней мере, более 4 недель.
Лечение хронического гастрита, вызванного Helicobacter pylori (хеликобактер пилори) следует повторить в случае сохранения Н. pylori. В случае неэффективности повторных курсов лечения некоторые авторы рекомендуют эндоскопическое получение культуры для исследования ее чувствительности к препаратам.
Источник