Каскад корреа при гастрите
Содержание статьи
Хронический гастрит: Предраковые состояния желудка и каскад Р.Correa
Важным аспектом в диагностике хронического гастрита (ХГ), является определение предракового перерождения желудочного эпителия.
Важным аспектом в диагностике хронического гастрита (ХГ), является определение предракового перерождения желудочного эпителия.
Исходя из проведенных исследований Р.Correa в 1988, были сделаны выводы, что слизистая оболочка желудка изменяется в определенной патологической последовательности, от ее физиологического состояния до проявления рака.
Желудочный канцерогенез — это очень сложный, последовательный и многостадийный процесс. Таким образом, ХГ прогрессирует с ростом атрофии и кишечной метаплазии. У определенного числа пациентов метаплазированный эпителий становится подверженным к геномным и фенотипическим модификациям с образованием дисплазии с возможным перерождением в инвазивную опухоль.
На сегодняшний день, атрофию и дисплазию слизистой оболочки желудка считают предраковыми изменениями, то есть это те изменения, у которых высокий риск перерождения в рак желудка.
Атрофия слизистой желудка, причины ее возникновения и этапы развития.
Во время атрофических изменений слизистой желудка, наблюдается потеря желудочных желез с заменой на метаплазированный эпителий или фиброзную ткань. Данный процесс возникает в результате длительно текущего воспалительного процесса слизистой, и как следствие, нарушается нормальная регенерация клеток, железы начинают погибать.
Существует два варианта развития атрофии при наличии Helicobacter pylori:
- В результате прямого повреждения или воспалительного ответа, происходит разрушение железистого аппарата.
- Вследствие избирательного разрушения клеток железистого эпителия с сбережением стволовых клеток.
Бактериальные протеазы, которые высвобождаются за счет активированных нейтрофилов, способны уничтожать стволовые клетки и железистый эпителий. Также вырабатываемые аутоантитела взаимодействуют с эпитопами протонной помпы париетальных клеток.
Непосредственное травмирование эпителия продуктами жизнедеятельности бактерий не совсем разъясняет распространение и усиление атрофического процесса желез, так как бактерии расположены на поверхностном и ямочном эпителии.
В результате уменьшения железистой ткани наблюдается ее замещение фиброзной тканью. Во время атрофических проявлений, возникает потеря функционально активных специализированных клеток, клеточные элементы фундальных желез замещаются на тубулярные железистые структуры из шеечных мукоцитов. Такого рода атрофия наблюдается у пациентов с аутоиммунным гастритом.
Существует взаимосвязь между возрастом пациента и тяжестью развития атрофии слизистой желудка, чем пациент старше, тем тяжелее и быстрей развивается атрофический процесс.
В таких случаях можно наблюдать, как слизистая оболочка желудка антрального типа переходит на область тела желудка со смещением в проксимальном направлении границы тело/антрум. Иногда, данная пилоризация желез тела желудка возникает мультифокально по всей слизистой оболочки желудка. Эта атрофия зачастую ярко выражена на малой кривизне в участке инцизуры.
Атрофический процесс нельзя полностью связывать с процессами старения организма, так как у пожилых людей при нормальной кислотности, проявления атрофии не наблюдаются. Пусковым механизмом здесь выступает присоединение Helicobacter pylori, также атрофия может возникать в результате аутоиммунного гастрита и продолжительного рефлюкс-гастрита. Механизмы развития гастрита, прежде всего, зависят от этиологии.
Утрата желез, при аутоиммунном (тип А) гастрите связана с антителами, хотя нельзя исключать и воздействия Т- клеточной цитотоксичности.
При ассоциированном повреждении слизистой оболочки желудка бактериями Helicobacter pylori, был выявлен феномен молекулярной мимикрии. У ста исследуемых пациентов с Helicobacter pylori были обнаружены аутоантитела, которые взаимодействовали с желудочными антигенами. Максимальная активность аутоантител проявлялась в зоне эпителиоцитов желудочных желез, также была обнаружена корреляция между лимфоцитарной инфильтрацией в зоне шеечных эпителиоцитов при наличии аутоантител.
Исследователи выдвинули предположение, что формированию антител способствует перекрестная реакция с антигенными детерминантами муцина, которые образуются в процессе регенерации желудочного эпителия.
Стоит отметить, что у пациентов с аутоантителами чаще находили атрофию желез и лимфоцитарную инфильтрацию, чем у пациентов без аутоантител с наличием Helicobacter pylori. Таким образом, можно сделать вывод, что хроническая аутоиммунная агрессия против эпителия желудка может быть причиной возникновения атрофии и метаплазии в слизистой оболочке желудка при хеликобактерном гастрите. Степень проявления антигенной мимикрии влияет на увеличение атрофии, но это относится не ко всем случаям.
Атрофия при рефлюксе желчи возникает как следствие повторного эрозирования слизистой оболочки желудка из-за воздействия на нее желчными кислотами или лизолецитином в сочетании с кислотой, также причиной может быть хронический реактивный или химический гастрит.
Источник
Каскад Correa: современное состояние проблемы (литературный обзор)
Многопрофильный медицинский центр Банка России
Цель обзора. Анализ каскада Correa. Обзор морфологических типов атрофии, кишечной метаплазии и дисплазии слизистой оболочки желудка (СОЖ) как этапов гастроканцерогенеза. Основные положения. Каскад Correa – последовательное развитие аденокарциномы желудка путем прогрессирования предраковых изменений СОЖ. Этапы каскада Correa рассматриваются как предраковые изменения СОЖ, пусковым механизмом развития которых является обсеменение СОЖ Нelicobacter pylori (Н. pylori). Благодаря разработанным системам оценки состояния СОЖ при хроническом гастрите, а также проводимым молекулярно-биологическим и генетическим исследованиям каскад Correa получил четкую морфологическую характеристику развития на каждом этапе, что позволяет разработать последовательный план ведения пациентов с целью канцерпревенции. Заключение. Каскад Correa – последовательное развитие аденокарциномы желудка путем прогрессирования предраковых изменений СОЖ. Эрадикационная терапия у больных с предопухолевыми изменениями СОЖ позволяет снизить риск развития рака желудка. Пациентам с запущенным H. pylori гастроканцерогенезом необходимы динамическое наблюдение и лечение в зависимости от уровня выявленных морфологических изменений.
Множественные интерпопуляционные исследования, проведенные в течение первого десятилетия XXI в., показали, что с нарастанием предопухолевых изменений нарастает и заболеваемость раком.
В 1988 г. Р. Correa постулировал последовательность патологических изменений в слизистой оболочке желудка (СОЖ) при хроническом гастрите (ХГ) от нормального состояния до возникновения рака (рис. 1).
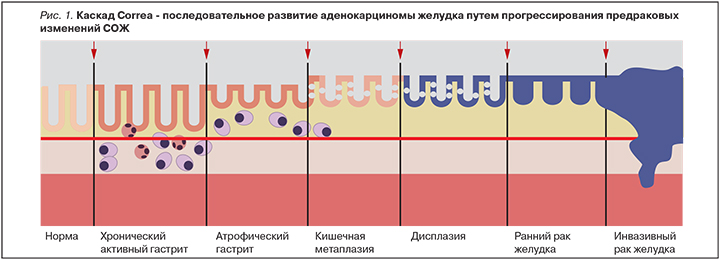
Этапы каскада Correa – атрофия, кишечная метаплазия (КМ) и дисплазия – рассматриваются как предраковые изменения СОЖ. Впоследствии процесс перестройки СОЖ был модифицирован P. Correa с включением роли Н. pylori в начало последовательности патологических изменений.
«Золотым стандартом» диагностики патологических изменений СОЖ на современном уровне развития медицинской науки и практики является эзофагогастродуоденоскопия с применением витальных красителей или использованием режимов увеличительной ZOOM- и узкоспектральной NBI-эндоскопии, что позволяет произвести прицельную биопсию с высокой вероятностью выявления изменений на раннем этапе развития.
В настоящее время под термином «каскад Correa» понимают последовательное развитие аденокарциномы желудка путем прогрессирования предраковых изменений СОЖ.
В 2005 г. двое патологов, M. Rugge (Италия) и R. Genta (США), предложили использовать новую систему классификации ХГ, оценки его степени и стадии. Под степенью гастрита понималась выраженность суммарной воспалительной инфильтрации (нейтрофильными лейкоцитами и мононуклеарными клетками), под стадией — выраженность атрофии. Данная система получила название международной классификации ХГ (Сиднейская система и ее Хьюстонская модификация [10]).
В 2008 г. была сформирована новая международная группа, включающая ряд известных экспертов-патологов и гастроэнтерологов-клиницистов – Atrophy Club, которая разработала систему определения стадий ХГ под названием OLGA и OLGIM [10, 11, 12]. В ней использован интегральный подход с оценкой гистологической выраженности атрофии в антральном отделе и теле желудка с определением количества баллов в каждом биоптате.
Благодаря разработанным системам оценки состояния СОЖ при ХГ, а также проводимым молекулярно-биологическим и генетическим исследованиям каскад Correa получил четкую морфологическую характеристику развития на каждом этапе [8, 10].
Согласно предложенной модели, ХГ прогрессирует с развитием атрофии и КМ. А при определенных геномных изменениях у лиц с метаплазированным эпителием происходит развитие дисплазии с возможным прогрессированием в инвазивную опухоль.
ОБСЕМЕНЕНИЕ НELICOBACTER PYLORI
Главной морфологической особенностью хеликобактерного гастрита (синонимы: хронический антральный гастрит, гастрит типа В) является наличие на СОЖ самих Н. pylori, которые выявляются не только в бактериальной форме, но и в виде кокков.
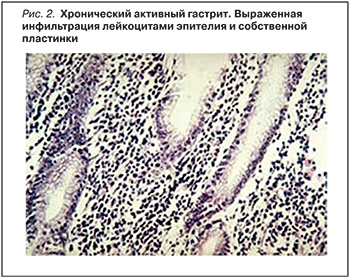 Первым этапом развития инфекции является колонизация СОЖ бактериями с последующим преодолением кислотного и слизисто-бикарбонатного барьеров желуд…
Первым этапом развития инфекции является колонизация СОЖ бактериями с последующим преодолением кислотного и слизисто-бикарбонатного барьеров желуд…
Г.В. Белова, О.С. Руденко
Источник
современное состояние проблемы (литературный обзор)
- Архив журнала
/ - 2018
/ - №2
Каскад Correa: современное состояние проблемы (литературный обзор)
Г.В. Белова, О.С. Руденко
Многопрофильный медицинский центр Банка России
Цель обзора. Анализ каскада Correa. Обзор морфологических типов атрофии, кишечной метаплазии и дисплазии слизистой оболочки желудка (СОЖ) как этапов гастроканцерогенеза. Основные положения. Каскад Correa – последовательное развитие аденокарциномы желудка путем прогрессирования предраковых изменений СОЖ. Этапы каскада Correa рассматриваются как предраковые изменения СОЖ, пусковым механизмом развития которых является обсеменение СОЖ Нelicobacter pylori (Н. pylori). Благодаря разработанным системам оценки состояния СОЖ при хроническом гастрите, а также проводимым молекулярно-биологическим и генетическим исследованиям каскад Correa получил четкую морфологическую характеристику развития на каждом этапе, что позволяет разработать последовательный план ведения пациентов с целью канцерпревенции. Заключение. Каскад Correa – последовательное развитие аденокарциномы желудка путем прогрессирования предраковых изменений СОЖ. Эрадикационная терапия у больных с предопухолевыми изменениями СОЖ позволяет снизить риск развития рака желудка. Пациентам с запущенным H. pylori гастроканцерогенезом необходимы динамическое наблюдение и лечение в зависимости от уровня выявленных морфологических изменений.
Литература
Об авторах / Для корреспонденции
Галина Вячеславовна Белова, д.м.н., зам. главного врача по амбулаторно-поликлинической работе, зав. поликлиникой Многопрофильного медицинского центра Банка России. Адрес: 118791, Москва, Севастопольский пр-т,
д. 66. Тел.: (495) 771-98-60. E-mail: belovagv@inbox.ru
Оксана Сергеевна Руденко, врач-эндоскопист эндоскопического отделения Многопрофильного медицинского центра Банка России. Адрес: 118791, Москва, Севастопольский пр-т, д. 66. Тел.: (495) 676-82-28.
E-mail: rudenkoos@mail.ru
Похожие статьи
- Оценка клинического статуса пациента с дисплазией соединительной ткани: прогностически ориентированный подход
- Патогенетические механизмы развития предраковых изменений желудка у пациентов с синдромом Марфана
Источник
Гастрит после эрадикации Helicobacter pylori — простые следы или серьезные последствия?
Эволюция взаимоотношений инфекции Helicobacter pylori (НР) и человечества насчитывает не одно тысячелетие [1]. За этот период сформировались механизмы взаимодействия инфекта и хозяина [2], позволяющие бактерии модулировать уровень кислотной продукции, поддерживая воспаление слизистой оболочки желудка. Насколько важно для клинициста правильно интерпретировать данные о воспалении в слизистой оболочке желудка, ассоциированном с НР? С одной стороны, наличие и выраженность воспалительного инфильтрата не определяет наличие у больного клинических симптомов диспепсии, возникающих вследствие нарушений желудочной секреции, гастродуоденальной моторики, висцеральной чувствительности, нередко обусловленных нервно-психическими факторами. Неслучайно поэтому ни одна из трех современных классификаций хронического гастрита («Сиднейская», 1990; «Хьюстонская», 1994; классификация OLGA, 2008) не содержит раздела, касающегося оценки клинических проявлений. Почему же тогда внимание клинициста сосредоточено на данных заключения патолога? Почему в процессе создания классификации хронического гастрита стало необходимым участие клиницистов? Ответ кроется в целевых установках классификационной системы — оценить состояние слизистой оболочки, дать характеристику воспалительного процесса для прогноза, на основе стандартизированного подхода дать возможность клиницисту персонифицировать программу наблюдения больного хроническим гастритом [3].
Сегодня можно с уверенностью сказать, что НР как один из представителей «медленных» инфекций — не новая угроза и не старый друг, и эрадикация бактерии рассматривается как фрагмент протокола лечения пациентов с НР-ассоциированной патологией [4, 5]. Однако специфическое хроническое воспаление слизистой оболочки желудка не исчезает вместе с элиминацией возбудителя [6].
Персистенция воспалительного инфильтрата в условиях элиминации инфекта не просто биологический феномен. Сохранение воспаления означает и сохранение риска повреждения слизистой оболочки желудка, что имеет практическое значение. Так, инфильтрация слизистой оболочки нейтрофильными лейкоцитами сопровождается выработкой активных форм кислорода («оксидативный стресс»), что приводит к прямому и опосредованному через цитокины повреждению эпителия слизистой и служит фактором риска образования язв и эрозий. С другой стороны, длительное воздействие активных форм кислорода приводит к необратимым повреждениям ДНК, которые накапливаются с течением времени и создают «стартовую площадку» для развития рака желудка. В норме нейтрофильная инфильтрация исчезает спустя лишь 1 месяц после успешной эрадикации хеликобактерной инфекции. Несколько позднее, путем активации апоптоза, уменьшается количество лимфоцитов и плазматических клеток. Последними подвергаются редукции лимфоидные фолликулы собственной пластинки: железы, раздвинутые воспалительным инфильтратом, занимают прежнее место, исчезает феномен «неопределенной атрофии». Эти процессы, развиваясь асинхронно, отличаются и разной скоростью редукции воспаления.
В проспективном когортном исследовании с включением 181 больного НР-ассоциированным гастритом, с синдромом диспепсии, период наблюдения с клинико-биопсийным контролем в динамике составил 1 год [7]. Уже через месяц после эрадикации НР было отмечено снижение прежде всего активности гастрита при более сдержанных темпах редукции мононуклеарной воспалительной инфильтрации. Выявлено, что выраженность признаков хронического воспаления в слизистой оболочке желудка уменьшалась медленнее у больных атрофическим гастритом, что согласуется с данными и других исследователей. В дальнейшем, наряду с регрессом воспалительного инфильтрата, происходило достоверное снижение индекса пролиферации и индекса апоптоза в эпителиоцитах слизистой оболочки желудка. С клинических позиций элиминация инфекта, способствуя нормализации темпов клеточного обновления, позволяет остановить прогрессирование предраковых изменений слизистой оболочки желудка, является мерой профилактики рака желудка.
Характерным для годичного постэрадикационного периода было «исчезновение» феномена неопределенной атрофии, что было связано с уменьшением плотности воспалительной инфильтрации и уходом пациентов в рубрику с истинной атрофией или без таковой. Вероятно, результаты ряда исследований, в которых у части пациентов обнаружено исчезновение атрофии слизистой оболочки желудка в течение 1–2 лет после эрадикации инфекта, обусловлены именно тем обстоятельством, что из наблюдения не были исключены пациенты с феноменом неопределенной атрофии. Вместе с тем имеются и данные исследований с более длительным периодом наблюдения (более 7–10 лет), обнадеживающие в отношении некоторой регрессии степени атрофии слизистой оболочки желудка при элиминации НР.
Анализ результатов гистологического исследования гастробиоптатов через 1 год от эрадикации инфекта позволил выявить три группы больных:
- восстановление структуры слизистой оболочки желудка (полная редукция воспалительных изменений слизистой оболочки желудка, содержание межэпителиальных лимфоцитов (1–5 на 100 эпителиоцитов) соответствует норме) отмечено у 24 (13,2%) пролеченных;
- частичный регресс воспалительных изменений при гистологическом исследовании гастробиоптатов выявлен у 106 (58,6%) больных;
- сохранение выраженности воспалительных изменений в слизистой оболочке желудка и спустя 1 год после элиминации возбудителя зафиксировано у 51 (28,2%) пациента.
В отсутствие НР основным фактором, определяющим темп клеточного обновления в слизистой оболочке желудка, становится мононуклеарный воспалительный инфильтрат собственной пластинки слизистой оболочки (рис. 1), который осуществляет реализацию программы апоптоза через систему FasL-FasR межэпителиального CD8-лимфоцита и мукоцита [8]. При анализе иммуногистохимических показателей клеточного обновления эпителиоцитов слизистой оболочки желудка у пациентов с различными вариантами течения постэрадикационного периода (восстановление структуры слизистой оболочки, уменьшение выраженности воспаления, персистенция воспалительного инфильтрата) выяснено, что показатели пациентов первой и третьей групп имеют статистически достоверные различия, что согласуется с полученными данными о существовании прямой корреляционной связи индекса апоптоза, индекса пролиферации эпителиоцитов и выраженностью мононуклеарной инфильтрации собственной пластинки слизистой оболочки желудка.
.jpg) |
Рис. 1. Персистенция мононуклеарного воспалительного инфильтрата впостэрадикационном периоде – фактор, определяющий темпы клеточного обновления эпителиоцитов слизистой оболочки желудка |
Следует признать, что течение постэрадикационного периода хронического гастрита гетерогенно и определяется особенностями межклеточных взаимодействий воспалительного инфильтрата и эпителия слизистой оболочки желудка, сложившимися еще на этапе формирования системы «инфект–хозяин».
Успешно проведенная антихеликобактерная терапия приводит к патоморфозу хронического НР-ассоциированного гастрита, что требует указания факта эрадикации возбудителя при формулировке диагноза. Такая стратегия не вступает в противоречие с общепринятой МКБ-10, но позволяет расширить представление об НР-ассоциированном хроническом гастрите.
Безусловно, проведение эрадикации несет в себе потенциал нормализации клеточного обновления, что, собственно, и является мерой канцерпревенции. Вместе с тем сохраняющаяся определенное время воспалительная инфильтрация слизистой оболочки желудка ассоциирована с возможностью повреждения клеток [9], в том числе и за счет повышенной активности ферментов перекисного окисления липидов — циклооксигеназы-2 (COX-2) и индуцибельной синтазы окиси азота (INOS) — белков, участвующих в канцерогенезе в течение года после состоявшейся эрадикации [10].
Таким образом, для пациентов с экс-хеликобактерным гастритом необходимо в программу курации включать курсы муко/цитопротективной терапии, позволяющей защитить клетки слизистой оболочки желудка от повреждающего действия продуктов воспаления с целью профилактики прогрессирования гастрита [11].
Группа муко/цитопротекторов сегодня включает несколько лекарственных средств (табл.), среди которых следует отдельно выделить терапевтические возможности висмута трикалия дицитрата (Де-Нола). В многочисленных исследованиях показано, что висмута трикалия дицитрат образует защитный слой на пораженных участках слизистой оболочки, предохраняя ее от воздействия агрессивных факторов, стимулирует секрецию слизи и гидрокарбоната, ингибирует активность пепсина, предохраняет эпителиальные факторы роста от распада, способствуя регенерации клеток эпителия, улучшает микроциркуляцию, стимулирует секрецию гастрозащитных простагландинов.
.gif)
Накопленный в течение десятилетий опыт проведения эрадикационной терапии и последующего наблюдения больных с различными стадиями гастрита в постэрадикационном периоде позволил выявить еще одну проблему. В условиях уже сформировавшейся атрофии слизистой оболочки желудка элиминация инфекта не позволяет решить проблему контаминации слизистой оболочки желудка не-НР микроорганизмами [12], в том числе Helicobacter spp. [13], Proteus mirabilis, Citrobacter freundii, Klebsiella pneumoniae, Enterobacter cloacae, Staphylococcus aureus, с дополнительным стимулом к персистенции воспалительного инфильтрата, активизации процессов перекисного окисления липидов и выработкой бактериями нитрозаминов, несущих проканцерогенный потенциал [14]. Аналогичная картина может сформироваться и при естественном течении гастрита, известном клиницисту в качестве «каскада P. Correa» (рис. 2).
.jpg) |
Рис. 2. Каскад P. Correa (цит. по [15]) |
Как быть в этой ситуации клиницисту? Выбрать лишь наблюдательную тактику? Проводить повторные курсы антибактериальной терапии? Вероятно, проведение крупных перспективных мультицентровых исследований позволит в дальнейшем найти ответ и на этот вопрос, определить целесообразность, компоненты и сроки такой терапии, но каковы наши возможности уже сейчас? Мы полагаем, что в такой ситуации клиницисту следует рассмотреть включение в программу курации пациента наряду с клинико-биопсийным контролем и проведение курсов терапии препаратами висмута. Во-первых, не являясь антибиотиком, висмута трикалия дицитрат подавляет активность бактериальной флоры без риска формирования резистентности, что успешно применяется уже в течение многих лет в стандартной эрадикационной терапии. Во-вторых, в условиях персистенции воспаления становятся необходимыми свойства Де-Нола, влияющие на активность воспалительного процесса, а именно снижение содержания провоспалительных цитокинов и наличие антиоксидантного эффекта. Следует отметить, что эти свойства препарата успешно используются и при лечении других заболеваний, в т. ч. и кишечника. В-третьих, пациенты с атрофическим гастритом особенно нуждаются в мукоцитопротекторной терапии с повышением продукции слизи, простагландинов, улучшением микроциркуляции в слизистой оболочке желудка.
Таким образом, анализ данных литературы и результаты собственных исследований позволяют говорить о персистенции воспалительного инфильтрата после элиминации НР, при этом течение гастрита в постэрадикационном периоде определяется прежде всего сформировавшимся воспалением еще на этапе инфицирования хозяина НР. Сохранение воспалительного инфильтрата требует активной курации пациента для максимально полной и быстрой редукции изменений слизистой оболочки желудка и предотвращения прогрессирования гастрита. Для эффективной и безопасной терапии больных в постэрадикационном периоде следует рассматривать в качестве препаратов выбора, особенно при атрофии слизистой оболочки желудка и высокой степени гастрита, препараты висмута (Де-Нол).
Литература
- Amieva M. R. Host-bacterial interactions in Helicobacter pylori infection/M. R. Amieva, E.M. El-Omar // Gastroenterology. 2008. Vol. 134, № 1. P. 306–323.
- Ricci V., Romano M., Boquet P. Molecular cross-talk between Helicobacter pylori and human gastric mucosa. World J Gastroenterol 2011; 17 (11): 1383–1399.
- Dai Y. C., Tang Z. P., Zhang Y. L. How to assess the severity of atrophic gastritis. World J Gastroenterol 2011; 17 (13): 1690–1693.
- Malfertheiner P. Guidelines for the Management of Helicobacter pylori Infection Summary of the Maastricht-3 2005 Consensus Report / P. Malfertheiner, F. Megraud, C. O’Morain // Вusiness briefing: Еuropean gastroenterology review. 2005. Р. 59–60.
- Осипенко, М. Ф. Программа для участковых терапевтов «эффективная эрадикация» / М. Ф. Осипенко и др. // Гастроэнтерология Санкт-Петербурга. 2008. № 2–3. С. М91.
- Кононов А. В. Воспаление как основа Helicobacter pylori-ассоциированных болезней: от гастрита — до рака желудка / А. В. Кононов // Труды II съезда Российского общества патологоанатомов. М., 2006. С. 229–231.
- Ливзан М. А. Течение хронического гастрита, ассоциированного с Helicobacter pylori в постэрадикационном периоде / М. А. Ливзан, А. В. Кононов, С. И. Мозговой // Экспериментальная и клиническая фармакология. 2007. № 5. С. 116–123.
- Expression of HLA-DR, costimulatory molecules B7–1, B7–2, intercellular adhesion molecule-1 (ICAM-1) and Fas ligand (FasL) on gastric epithelial cells in Helicobacter pylori gastritis; influence of H. pylori eradication / A. Archimandritis [et al.] // Clin. Exp. Immunol. 2000. Vol. 119. P. 464–471.
- Yoshimura T., Shimoyama T., Tanaka M., Sasaki Y., Fukuda S., Munakata A. Gastric mucosal inflammation and epithelial cell turnover are associated with gastric cancer in patients with Helicobacter pylori infection. J Clin Pathol 2000; 53: 532–536.
- Sung Soo Kim, Young Jick Sung, Min Kyoung Park et al. The Change of Cyclooxygenase-2 and Inducible Nitric Oxide Synthase in the Gastric Mucosa One Year after Eradication of Helicobacter pylori Korean J Gastroenterol 2008; 52: 286–292.
- Tulassay Z., Herszenyi L. Gastric mucosal defense and cytoprotection. Best Pract Res Clin Gastroenterol. 2010 Apr; 24 (2): 99–108.
- Takako Osaki, Katsuhiro Mabe, Tomoko Hanawa and Shigeru Kamiya. Urease-positive bacteria in the stomach induce a false-positive reaction in a urea breath test for diagnosis of Helicobacter pylori infection Journal of Medical Microbiology (2008), 57, 814–819.
- Cinthia G. Goldman and Hazel M. Mitchell. Helicobacter spp. other than Helicobacter pylori 2010 Blackwell Publishing Ltd, Helicobacter 15 (Suppl. 1): 69–75.
- Correa P. A human model of gastric carcinogenesis. Cancer Res 1988; 48: 3554–3560.
- Correa P. Chronic gastritis as a cancer precursor. Scand J Gastroenterol Suppl. 1984; 104: 131–6.
М. А. Ливзан, доктор медицинских наук
С. И. Мозговой, доктор медицинских наук
А. В. Кононов, доктор медицинских наук, профессор
ГОУ ВПО «Омская государственная медицинская академия Минздравсоцразвития России», Омск
Контактная информация об авторах для переписки: mlivzan@yandex.ru
Источник