Хеликобактер ассоциированный гастрит патогенез
Содержание статьи
Механизм развития (патогенез) связанного с хеликобактер гастрита
В отличие от острого гастрита симптомы хронического гастрита обычно менее выражены, но более постоянны. Могут возникать тошнота и дискомфорт в верхних отделах живота, иногда сопровождающиеся рвотой, но кровавая рвота нехарактерна. Самой частой причиной развития хронического гастрита является инфицирование H. pylori. До того как была признана главная роль H. pylori, первопричиной хронического гастрита считали другие постоянные раздражители, включая психологический стресс, кофеин, употребление алкоголя и курение.
Аутоиммунный гастрит (самая частая причина развития атрофического гастрита) составляет менее 10% всех наблюдений хронического гастрита и является наиболее частой формой хронического гастрита среди пациентов без инфекции H. pylori. Реже хронический гастрит индуцируется лучевой терапией, хроническим рефлюксом желчи, механической травмой или системными заболеваниями, например болезнью Крона, амилоидозом, болезнью «трансплантат против хозяина».
Открытие H. pylori произвело революцию в нашем понимании хронического гастрита. Эти спиралевидные или изогнутые микроорганизмы выявляют в биоптатах желудка практически у всех пациентов с язвой двенадцатиперстной кишки и у большинства лиц с язвой желудка или хроническим гастритом. В своем знаменитом эксперименте лауреат Нобелевской премии Барри Маршалл выпил раствор, содержащий H. pylori, и спровоцировал у себя слабовыраженный гастрит. Именно такой, не совсем правильный и безопасный способ изучения инфекционных заболеваний показал патогенность H. pylori.
Острая инфекция H. pylori в большинстве случаев не сопровождается какими-либо заметными симптомами, и медицинская помощь не нужна, однако хронический гастрит в конечном итоге заставляет пациента обратиться к врачу. H. pylori обнаруживают у 90% лиц с хроническим гастритом, преимущественно антральным. H. pylori играет важную роль в развитии других заболеваний желудка и двенадцатиперстной кишки.
Например, повышение секреции соляной кислоты, которое происходит при хеликобактер-ассоциированном гастрите, может стать причиной язвенной болезни. Кроме того, инфекция H. pylori повышает риск развития рака желудка.
а) Эпидемиология. В США к рискам инфицирования H. pylori относят бедность, перенаселение, этническую принадлежность (представители негроидной расы и потомки коренных жителей Мексики имеют повышенный риск), низкий уровень образования, проживание в сельской местности и рождение за пределами США. Во всем мире уровень колонизации H. pylori варьирует от 10 до 80%. В областях с высоким уровнем колонизации H. pylori инфицирование происходит еще в детском возрасте, затем инфекция персистирует в течение десятилетий.
Способ передачи H. pylori точно не определен, но поскольку люди являются единственными известными резервуарами инфекции, наиболее вероятными путями ее передачи служат орально-оральный, фекально-оральный и бытовой. Сходный микроорганизм H. heilmannii вызывает аналогичное заболевание, но его резервуарами являются кошки, собаки, свиньи и приматы. Морфологически H. pylori и H. heilmannii едва различимы, однако идентификация инфекции H. heilmannii важна, т.к. указывает на необходимость лечения домашних животных с целью предотвращения реинфицирования хозяина животного.
б) Патогенез. Инфекция H. pylori — самая частая причина развития хронического гастрита. Заболевание в основном проявляется в форме антрального гастрита с гиперсекрецией соляной кислоты в условиях гипогастринемии. У таких пациентов повышен риск развития язвы двенадцатиперстной кишки, а кардиальный отдел вовлекается в процесс очень редко. У многих пациентов гастрит прогрессирует и вовлекает тело и дно желудка (пангастрит).
H. pylori адаптировалась к существованию в особой экологической нише, представленной слизью на поверхности желудочного эпителия. Хотя H. pylori может внедряться в слизистую оболочку желудка, это не выявляется при гистологическом исследовании, поэтому роль такой инвазии в развитии заболевания неизвестна.
Существуют 4 фактора, обеспечивающие вирулентность H. pylori:
— жгутик, позволяющий бактерии двигаться в густой слизи;
— уреаза, образующая аммиак из эндогенной мочевины и таким образом повышающая в желудке уровень pH локально;
— адгезины, усиливающие прилипание бактерии к поверхности фовеолярных клеток;
— цитотоксип-ассоциированный ген А (CagA), который может быть вовлечен в развитие язвы или рака (этот механизм не до конца изучен).
Механизмы, посредством которых H. pylori вызывает гастрит, определены не полностью, однако известно, что инфицирование приводит к увеличению секреции соляной кислоты и нарушению нормальных защитных механизмов в желудке и двенадцатиперстной кишке. Таким образом, хеликобактер-ассоциированный гастрит является результатом нарушения баланса между факторами защиты слизистой оболочки желудка и двенадцатиперстной кишки и повреждающими эту защиту факторами.
Со временем хронический хеликобактер-ассоциированный антральный гастрит прогрессирует до пангастрита, который сопровождается мультифокальной атрофией слизистой оболочки (мультифокальный атрофический гастрит), снижением секреции соляной кислоты, кишечной метаплазией и повышенным риском развития аденокарциномы желудка. Механизмы, лежащие в основе этого процесса, неизвестны, но решающую роль, вероятно, играют взаимодействия между организмом-хозяином и бактерией.
Например, некоторые типы полиморфизмов гена, кодирующего синтез провоспалительного цитокина IL-1b, коррелируют с развитием пангастрита после инфицирования H. pylori. Полиморфизм гена TNF и ряда других генов, связанных с воспалительным ответом, также влияет на исход инфекции H.pylori. Тяжесть заболевания может быть обусловлена генетическими особенностями штаммов H. pylori. Например, ген CagA (маркер патогенности) определяется в 50% всех штаммов H. pylori и в 90% штаммов этого микроорганизма, выделенных в популяциях с высоким риском развития рака желудка.

в) Морфология. В биоптатах слизистой желудка инфицированных пациентов обычно определяется H. pylori. Микроорганизмы концентрируются в поверхностном слое слизи, покрывающей эпителиальные клетки и шеечную часть желез. Распределение H. pylori может быть неравномерным, участки массивной колонизации могут граничить с областями, где присутствуют одиночные микроорганизмы. В тяжелых случаях бактерии полностью покрывают всю люминальную поверхность фовеолярных и шеечных клеток и даже могут проникать в желудочные ямки. Микроорганизмы лучше выявляются с помощью специального окрашивания.
H. pylori обладает тропизмом к эпителию желудка и обычно не обнаруживается в участках кишечной метаплазии слизистой оболочки желудка и в двенадцатиперстной кишке. Однако H. pylori можно обнаружить в участках пилорической метаплазии хронически поврежденной слизистой оболочки двенадцатиперстной кишки или в слизистой оболочке желудочного типа при пищеводе Барретта.
Обычно H. pylori выявляют в антральном отделе желудка. Кардиальный отдел, несмотря на четкую взаимосвязь между колонизацией его и антрального отдела, поражается достаточно редко. Наличие H. pylori нехарактерно для кислотопродуцирующей слизистой оболочки дна и тела желудка, за исключением случаев массивной колонизации. Таким образом, для диагностики хеликобактер-ассоциированного гастрита предпочтительна биопсия из антрального отдела желудка. При эндоскопическом исследовании слизистая оболочка антрального отдела, инфицированная H. pylori, обычно гиперемирована и имеет крупнозернистый или узелковый вид.
Воспалительный инфильтрат, как правило, характеризуется различным количеством нейтрофилов в собственной пластинке слизистой оболочки желудка, включая те, которые проникают через базальную мембрану и становятся внутриэпителиальными, а также попадают в просвет желудочных ямок, формируя в них абсцессы. В дополнение к этому в поверхностных отделах собственной пластинки определяется большое количество плазматических клеток, часто в виде скоплений или пластов, атакже многочисленные лимфоциты и макрофаги. Внутриэпителиальные нейтрофилы и субэпителиальные плазматические клетки являются характерным признаком хеликобактер-ассоциированного гастрита.
Активный воспалительный процесс может привести к утолщению желудочных складок, внешне похожему на раннее инфильтративное образование. Длительно существующий хеликобактер-ассоциированный гастрит может распространиться на тело и дно желудка, а слизистая оболочка может стать атрофичной. Часто присутствуют лимфоидные скопления, иногда содержащие герминативные центры, и могут представлять собой лимфоидную ткань, ассоциированную со слизистыми оболочками, которая может трансформироваться в MALT-лимфому.
г) Клинические признаки. Помимо гистологического исследования существуют и другие диагностические методы, позволяющие обнаружить микроорганизмы: неинвазивный серологический тест на определение антител к H. pylori, анализ кала; уреазный дыхательный тест, основанный на способности бактериальной уреазы образовывать аммиак. При исследовании биопсийного материала слизистой оболочки желудка проводят быстрый уреазный тест или бактериальный посев, а с помощью ПЦР выделяют бактериальную ДНК.
Эффективным способом лечения инфекции H. pylori является комбинированное применение антибиотиков и препаратов из группы ингибиторов протонной помпы. Пациенты с хеликобактер-ассоциированным гастритом после такой терапии обычно выздоравливают, однако в случае неполной эрадикации возбудителя или реинфицирования может произойти рецидив заболевания. Разработка вакцины для профилактики и лечения инфекции H. pylori все еще находится на ранних этапах исследования. Язвенная болезнь, являющаяся осложнением хронического хеликобактерассоциированного гастрита, описана далее.

Хеликобактер-ассоциированный гастрит:
(А) Спиралевидные Helicobacter pylori хорошо видны при импрегнации серебром по методу Уортина-Старри.
В поверхностном слое слизи определяется большое количество микроорганизмов.
(Б) Многочисленные внутриэпителиальные нейтрофилы, а также нейтрофилы в области собственной пластинки слизистой оболочки желудка.
(В) Лимфоидные скопления с герминативными центрами,
а также многочисленные субэпителиальные плазматические клетки в поверхностных отделах собственной пластинки слизистой оболочки желудка являются характерным признаком хеликобактер-ассоциированного гастрита.
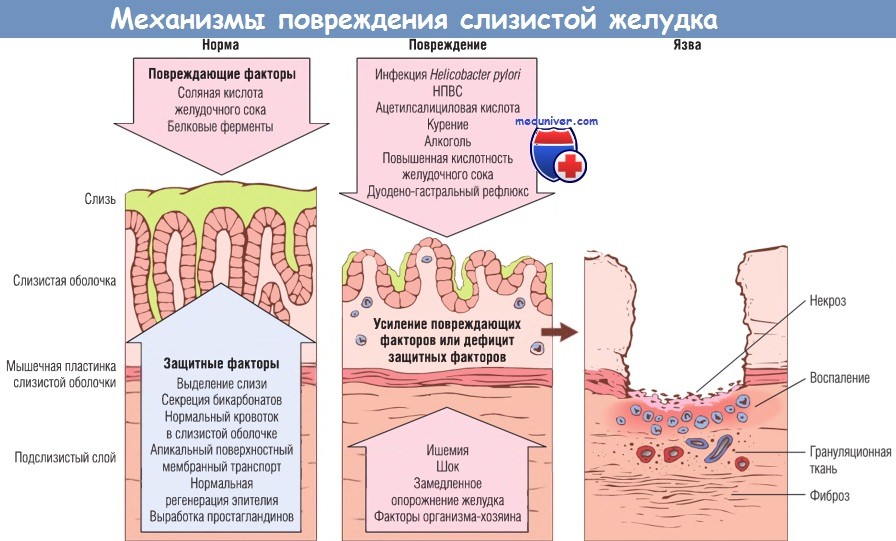
Механизмы повреждения (от легких форм к изъязвлению, которое может осложнить острый или хронический гастрит) и защиты слизистой оболочки желудка.
Дно язвенного дефекта представлено слоями некротизированных клеток, воспалительных клеток, грануляционной ткани и фиброзной ткани.
Фиброз, для развития которого нужно определенное время, наблюдается только при хронических поражениях.
НПВС — нестероидные противовоспалительные средства.
— Рекомендуем ознакомиться со следующей статьей «Механизм развития (патогенез) аутоиммунного гастрита»
Оглавление темы «Патогенез болезней пищевода и желудка»:
- Механизм развития (патогенез) аденокарциномы пищевода
- Механизм развития (патогенез) плоскоклеточного рака пищевода
- Механизм развития (патогенез) доброкачественной опухоли пищевода
- Механизм развития (патогенез) острого гастрита
- Механизм развития (патогенез) острой язвы желудка
- Механизм развития (патогенез) связанного с хеликобактер гастрита
- Механизм развития (патогенез) аутоиммунного гастрита
- Механизм развития (патогенез) редких форм хронического гастрита
- Механизм развития (патогенез) язвенной болезни
- Механизм развития (патогенез) атрофии и дисплазии слизистой желудка
Источник
Хеликобактериоз
Хеликобактериоз — это латентное или манифестировавшее инфекционное заболевание, при котором слизистая желудка колонизируется хеликобактериями. Обычно протекает бессимптомно. При клинической манифестации проявляется болями, чувством тяжести и дискомфорта в эпигастрии, диспепсией, учащением дефекации. Для длительного течения характерны признаки анемизации: слабость, быстрая утомляемость, головокружения, головные боли. Диагностируется с помощью ИФА, ПЦР, дыхательного теста, эзофагогастродуоденоскопии и анализа биоптата. Стандартные схемы лечения предполагают назначение блокаторов протонного насоса, антибактериальных препаратов и солей висмута.
Общие сведения
Инфицирование хеликобактерией (Helicobacter pylori) наблюдается почти у 60% населения планеты. По данным наблюдений в сфере клинической гастроэнтерологии, распространенность хеликобактериоза напрямую зависит от материального уровня жителей: в развивающихся государствах этот показатель выше, чем в развитых, в семьях с годовым доходом более 70 тыс. долларов инфицированность встречается спорадически.
Кислотоустойчивые бактерии были впервые выделены из слизистой желудка австралийскими учеными Дж. Уорреном и Б. Маршаллом в 1982 году. Наиболее часто хеликобактериоз выявляется после 60 лет, повышенной восприимчивостью к хеликобактерной инфекции обладают больные с ослабленным иммунитетом.
Хеликобактериоз
Причины хеликобактериоза
Заболевание вызывается микроаэрофильной грамотрицательной бактерией Helicobacter pylori, реже другими видами хеликобактера, тропными к желудочному эпителию и устойчивыми в кислотной среде. Источниками заражения являются пациенты, страдающие явным или латентным хеликобактериозом, носители микроорганизма, домашние и сельскохозяйственные животные, у которых высеиваются другие разновидности хеликобактерий (H. acinonychis, H. felis, H. salomonis, H. mustelae).
Основными путями инфицирования являются алиментарный и водный. Возможно контактно-бытовое заражение при пользовании общими с носителем или больным посудой, полотенцами, зубной щеткой и другими предметами личной гигиены. Новорожденным детям возбудитель хеликобактериоза чаще всего передается контактно-бытовым способом. Патоген отличается относительной устойчивостью к окружающей среде: при кипячении хеликобактерии гибнут практически мгновенно, при обработке дезинфицирующими составами — в течение нескольких минут.
Патогенез
Механизм развития хеликобактериоза определяется особенностями колонизации бактерией слизистой желудка. Инфицирующей считается доза патогена от 10 тыс. до 1 млрд. микробных тел. Хеликобактерии адгезируются к желудочным эпителиоцитам, скапливаясь преимущественно в межклеточных промежутках, с помощью жгутиков мигрируют к участкам выделения мочевины и гемина, необходимых для жизнедеятельности возбудителей. Расщепление мочевины микробной уреазой до аммиака и двуокиси углерода позволяет создать вокруг колонии слой, защищающий хеликобактера от соляной кислоты.
Аммиак, цитотоксины и высокоактивные энзимы (муциназа, липаза, протеаза), продуцируемые микробом, разрушают слизисто-бикарбонатный барьер и оказывают повреждающее воздействие на желудочный эпителий. В зависимости от состояния защитных факторов желудка возникший инфекционный процесс может протекать латентно с минимальными патоморфологическими изменениями слизистой или остро с инфильтрацией эпителиальной оболочки, активацией системы простагландинов, выраженной клинической симптоматикой воспаления.
Хронический гастрит с инфильтрацией лимфоцитами антрального эпителия является продолжением острого процесса или следствием активации возбудителя при снижении иммунитета у пациентов с первично-латентной формой хеликобактериоза. Значительный дисбаланс между недостаточным защитным действием слизисто-бикарбонатного слоя и высокой агрессивностью желудочного сока приводит к формированию язвы желудка, дисплазии эпителиоцитов. Поражение двенадцатиперстной кишки и пищевода возможно только при желудочной метаплазии их эпителия.
Симптомы хеликобактериоза
Почти у 90% пациентов инфицирование H. pylori длительное время протекает бессимптомно и выявляется при обследовании по поводу других болезней ЖКТ. В случае быстрой первичной манифестации возбудителя у больных развивается острый период хеликобактериоза, который длится около 10 дней. Основными жалобами являются периодические боли в эпигастральной области, чувство тяжести, дискомфорта после приема пищи, тошнота. Может наблюдаться учащение дефекации, изменение характера стула. Пациенты жалуются на отрыжку, изжогу и вздутие живота.
Общее состояние больных обычно остается удовлетворительным, иногда отмечается кратковременный субфебрилитет, снижение работоспособности. После стихания острых проявлений хеликобактериоза отмечается периодический абдоминальный дискомфорт, тошнота и снижение аппетита. При хроническом течении заболевания и атрофическом поражении слизистой желудка возникают признаки анемии — частые головные боли и головокружения, бледность кожных покровов, снижение АД и тахикардия.
Осложнения
Наиболее частое последствие хеликобактериоза — усиление выработки соляной кислоты и гастрина, снижение факторов защиты, приводящее к возникновению хронического гастрита типа В. По мере прогрессирования заболевания формируются участки атрофии слизистой оболочки желудка, снижается кислотность. Хеликобактерная инфекция является причиной 95% язв двенадцатиперстной кишки, 80% язв желудка. В современных исследованиях доказана связь патологии с развитием гастроэзофагеальной рефлюксной болезни.
При хеликобактериозе снижается выработка внутреннего фактора Касла, что нарушает всасывание витамина В12 и вызывает мегалобластную анемию. При этом у пациентов, кроме типичных признаков анемии, возникают патогномоничные симптомы — лакированный язык, фуникулярный миелоз (поражение периферической нервной системы). Наиболее опасное осложнение патологии — метаплазия и дисплазия атрофированной слизистой, значительно повышающая риск рака желудка.
Диагностика
Постановка диагноза хеликобактериоза во время клинического осмотра пациента затруднена, что объясняется полиморфностью и неспецифичностью жалоб. Диагностический поиск включает комплексную лабораторно-инструментальную оценку состояния желудочно-кишечного тракта больного. Наиболее информативными для диагностики являются такие методы, как:
- Серологические реакции. Определение антител к хеликобактеру в крови с помощью иммуноферментного анализа используется для подтверждения инфицирования H. Pylori. Тест позитивный, если концентрация антител превышает 1,1 ед/мл, при значениях в диапазоне 0,9-1,1 единиц в 1 мл фиксируют сомнительный результат, который не исключает наличия хеликобактериоза.
- Дыхательный тест. Измерение концентрации меченых изотопов углерода в выдыхаемом воздухе после приема раствора мочевины основано на ферментативной активности H. Pylori и применяется для экспресс-диагностики. Диагностически значимым считается содержание 13С изотопов более 1,7%. Дыхательный тест на хеликобактер также назначают для контроля лечения.
- Эзофагогастродуоденоскопия. Визуализация верхних отделов ЖКТ при помощи гибкого эндоскопа — основной метод диагностики, позволяющий оценить состояние эпителия. При хеликобактериозе в ходе ЭГДС обнаруживается гиперемия и отечность слизистой тела желудка, пилорического отдела и верхней части 12-перстной кишки. Дополнительно производится эндоскопическая биопсия.
- Исследование биоптатов. Фрагмент патологически измененной слизистой оболочки используют для последующего быстрого уреазного теста — определения наличия хеликобактера. Изменение цвета индикатора с желтого на красный свидетельствует о положительном результате. В сомнительных случаях проводят цитоморфологическое исследование для изучения клеточного состава.
- Дополнительные анализы. В общем анализе крови в острой фазе хеликобактериоза выявляют умеренный лейкоцитоз и повышение СОЭ, при длительном течении болезни обнаруживают снижение показателей эритроцитов и гемоглобина, макроцитоз. Биохимический анализ крови без патологических изменений. Для определения хеликобактерной инфекции могут выполнять бактериологическое исследование — культивирование материала на специальных питательных средах.
Дифференциальная диагностика
В первую очередь дифференциальную диагностику заболевания проводят с функциональной диспепсией. Основными диагностическими критериями, свидетельствующими в пользу хеликобактериоза, являются наличие воспалительных изменений слизистой желудка и двенадцатиперстной кишки, выявление H. Pylori с помощью инвазивных методов исследования. В остром периоде болезнь нужно дифференцировать с кишечными инфекциями. Кроме гастроэнтеролога для обследования пациента привлекают инфекциониста.
Лечение хеликобактериоза
Выбор тактики зависит от клинического течения патологии. Выявленным носителям инфекции рекомендовано наблюдение. При развитии на фоне хеликобактерной инфекции гастрита, язвы желудка или двенадцатиперстной кишки, желудочной MALT-лимфомы назначается одна из трехкомпонентных, четырехкомпонентных или усеченных схем эрадикации хеликобактера. Консервативное лечение обычно длится 10-14 дней. С учетом решений Маастрихтских согласительных конференций и рекомендаций Научного общества гастроэнтерологов России для терапии хеликобактериоза могут применяться:
- Ингибиторы протонной помпы. Антисекреторные препараты блокируют Н+/К+-АТФазу париетальных клеток желудка, за счет чего угнетается продукция соляной кислоты. Снижение кислотности желудочного сока позволяет уменьшить его агрессивное воздействие на слизистую оболочку.
- Антибактериальные средства. При выборе препарата учитывают резистентность хеликобактера. Для элиминации патогена используют комбинацию макролидов или нитрофуранов с полусинтетическими пенициллинами или нитроимидазолами, тетрациклины, производные рифампицина.
- Коллоидные соли висмута. Висмут-содержащие препараты оказывают бактерицидное действие на хеликобактер. Усиливают защитные факторы слизистой желудка: формируют на поверхности эпителия защитную пленку, стимулируют секрецию бикарбонатов и простагландина Е2.
Прогноз и профилактика
Исход заболевания зависит от обратимости морфологических изменений слизистой ЖКТ и своевременности начатого лечения. У пациентов без сопутствующей патологии, прошедших полный курс антихеликобактерной терапии, прогноз благоприятный: возможна полная санация эпителия, нормализация кислотности. Профилактика хеликобактериоза включает соблюдение правил личной гигиены, рациональный режим питания (прием пищи 4-5 раз в день, исключение жареной, очень острой еды, копченостей), лабораторное обследование людей, которые были в контакте с инфицированным H. Pylori.
Источник