Дисплазия соединительной ткани гастрит
Содержание статьи
Особенности лечения атрофических гастритов у пациентов с недифференцированной дисплазией соединительной ткани
Библиографическое описание:
Чернуха, С. Н. Особенности лечения атрофических гастритов у пациентов с недифференцированной дисплазией соединительной ткани / С. Н. Чернуха. — Текст : непосредственный // Молодой ученый. — 2014. — № 10 (69). — С. 94-97. — URL: https://moluch.ru/archive/69/11941/ (дата обращения: 19.02.2021).
Нарушение функциональной активности клеточных элементов соединительной ткани при недифференцированной дисплазии соединительной ткани (НДСТ) способствует изменению репаративных процессов и образованию неполноценного коллагена, а также может быть весомым патогенетическим механизмом развития атрофии слизистой оболочки желудка. В ходе данного исследования бнаружена существенная динамика атрофии антрального отдела желудка на фоне применения антихеликобактерной схемы с коллоидным висмутом у больных с НДСТ (р<0,05). Это свидетельствует о положительном цитопротекторном эффекте препарата коллоидного висмута в антихеликобактерной схеме, а также о преобладании неопределённых атрофий у больных с НДСТ, требующих дифференциальной диагностики именно на фоне цитопротекторной терапии.
Ключевые слова: эрадикация, воспаление, атрофия, гастрит, Н. pylori
Введение
Современные научные данные по проблеме хронических заболеваний верхних отделов желудочно-кишечного тракта (ЖКТ), протекающих на фоне врожденной дисплазии соединительной ткани ограничены, касаются преимущественно анатомических аномалий и очень редко направлены на выявление гистологических особенностей патоморфоза с учетом нарушений синтеза коллагена [3,7]. Кроме того, отсутствует единое мнение относительно патогенетической роли данного синдрома в развитии заболеваний ЖКТ.
Синдром дисплазии соединительной ткани объединяет системные наследственные дифференцированные синдромы, в основе которых лежат хорошо известные дефекты генов (синдром Марфана, синдром Элерса — Данлоса и др.) и недифференцированные дисплазии соединительной ткани (НДСТ), при которых отмечаются микроаномалии со стороны практически всех органов и систем в той или иной комбинации [2,6]. Неполные, стертые формы, затрудняют своевременную диагностику и могут иметь необратимые последствия за счет развития тяжелых, а иногда и фатальных осложнений.
Детально изучены многие фенотипические признаки НДСТ, которые условно разделяют на внешние, выявляемые при физикальном обследовании, и внутренние анатомические признаки дисплазии соединительной ткани. Клинические проявления НДСТ отличаются вариабельностью, поэтому комплексная оценка фенотипических маркеров позволяет не только заподозрить, но и достоверно диагностировать наличие НДСТ уже на этапе физикального обследования больного [5,6].
Целью данного исследования стала оценка состояния слизистой оболочки желудка у пациентов с недифференцированной дисплазией соединительной ткани, а также динамика этих изменений на фоне антихеликобактерной терапии в зависимости от наличия стигм дисэмбриогенеза.
Материалы и методы
С целью изучения особенностей течения и лечения сочетанной патологии верхних отделов ЖКТ проводили сравнение результатов лечения у 132 Н. pylori-инфицированных больных с хроническими гастритами (ХГ) и стигмами дисембриогенеза, которые характерны для НДСТ (74 человека) и без них (58 человек). Все больные, независимо от наличия фенотипических признаков дисплазии соединительной ткани, были разделены на две группы, однородные по возрасту и полу: основную и контрольную. В контрольной группе пациенты получали лечение тройной антихеликобактерной терапией, включавшей кларитромицин, амоксициллин и эзомепразол в стандартных дозах в течение двух недель. Основную группу составили пациенты, которые лечились по схеме: коллоидного висмута субцитрат по 120 мг четыре раза в сутки + амоксициллин по 1000 мг дважды в сутки + кларитромицин по 500 мг дважды в сутки + эзомепразол по 20 мг дважды в сутки также в течение двух недель. С целью верификации диагноза хронического гастрита особое внимание уделяли результатам таких методов инструментальной диагностики как эзофагогастродуоденоскопия, морфология и рН-метрия. Инфицированность Н. pylori подтверждали ИФА, быстрым уреазный тестом и гистологическим методом. Морфологическую оценку гистологических препаратов слизистой оболочки желудка (СОЖ) проводили в соответствии с Сиднейской классификацией, Хьюстонского пересмотра, по модифицированной визуально аналоговой шкале системы Operative Link for Gastritis Assessment (шкала OLGA) [1,8] с полуколичественной оценкой инфицированности Н. pylori, активности воспаления и выраженности атрофии (от 0 до 3х баллов). Оценку фенотипических признаков недифференцированной дисплазии соединительной ткани проводили по стандартной методике [4]. Вероятность выявленных изменений определяли параметрическими и непараметрическими методами вариационной статистики.
Результаты и обсуждение
Все больные, с признаками и без признаков дисплазии соединительной ткани, имели морфологически подтвержденные атрофические и неатрофические гастриты, ассоциированные с хеликобактерной инфекцией. При детальном анализе данных об атрофических изменениях, наблюдалось существенное преобладание атрофии среди пациентов с НДСТ. Так, среди 34 больных с атрофическими гастритами (45,9 %) сочетание атрофии в антральном отделе и теле желудка наблюдалось у 11 человек, у 9 — атрофию обнаружили лишь в теле и у 14 — в антральном отделе. Среди 7 обследованных без НДСТ (12,1 %) сочетание атрофии в теле и антральном отделе желудка наблюдалось только в 2-х случаях, а в теле желудка — в 1 случае. Кишечная метаплазия в антральном отделе регистрировалась до лечения у 19 человек с НДСТ (25,7 %), причем у двоих она сочеталась с интестинальной метаплазией в теле желудка. В группе больных без НДСТ интестинальная метаплазия встречалась в 3-х случаях (5,2 %) и только в антральном отделе. Существенное преобладание атрофических изменений у больных с НДСТ по сравнению с больными без признаков НДСТ может свидетельствовать о роли дисплазии соединительной ткани в развитии и прогрессировании атрофических изменений наряду с персистенцией Н. pylori.
В контрольной группе антихеликобактерная схема с кларитромицином, амоксициллином и эзомепразолом имела эрадикационную эффективность — 82,8 %. У всех пациентов контрольной группы до лечения наблюдались выраженные воспалительные изменения в антральном отделе. В теле желудка активность воспалительного процесса была несколько меньше, но существенно не отличалась от показателя в антральном отделе. Гистологические изменения слизистой оболочки желудка у 64 пациентов до и после назначения антихеликобактерной терапии демонстрируют несущественное снижение активности воспалительного процесса в обоих топографических областях как у пациентов с ХГ без НДСТ, так и при ХГ с НДСТ (рис. 1).
Среди 68 человек основной группы эрадикационная эффективность антихеликобактерной схемы, включающей эзомепразол, амоксициллин, кларитромицин и коллоидного висмута субцитрат составила 88,2 %, что достоверно не превышает показатель полученный при лечении тройной схемой в контрольной группе. До назначения антимикробного лечения у всех пациентов основной группы отмечались гистологические изменения в антральном отделе, и частично — в теле желудка.
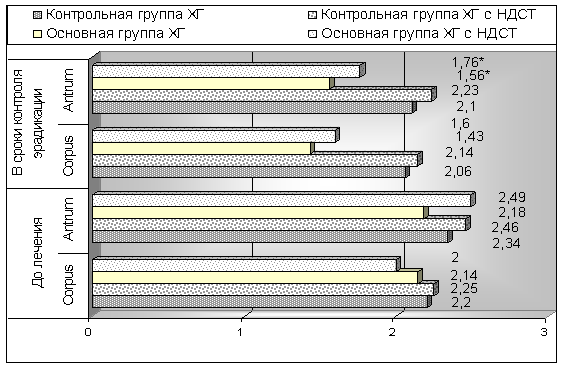
Рис. 1. Гистологические изменения слизистой оболочки желудка на фоне лечения в зависимости от наличия или отсутствия НДСТ
Примечание. * — Доcтоверная разница с аналогичным показателем (р<0,05), полученным до лечения.
При сравнении активности воспалительного процесса у всех больных наблюдалась несущественная разница между показателями тела и антрального отдела. Активность воспалительного процесса в антральном отделе у больных с НДСТ была выше, чем у пациентов без НДСТ. Однако, при сравнении этих данных с динамикой гистологических изменений в контрольной группе по топографическим отделам и наличию фенотипических стигм разницы не обнаружено. Общие показатели также указывают на несущественное преобладание степени активности гистологических изменений в теле по сравнению с антральным отделом в основной группе.
Морфологические показатели, полученные в сроки контроля эрадикации, свидетельствуют об общем снижении активности воспалительного процесса как в теле, так и в антральном отделе вне зависимости от наличия стигм дисэмбриогенеза. Наблюдается достоверное (р<0,05) снижение степени активности воспалительного процесса у пациентов основной группы (рис. 1). Важно отметить, что у пациентов контрольной группы такой динамики не зарегистрировано. Этот факт дополнительно свидетельствует о большей эффективности антихеликобактерной схемы с висмутом, чем схемы, которая применялась в контрольной группе.
Кроме активности воспалительного процесса привлекает внимание динамика атрофических изменений (рис. 2). В целом, этот показатель имел тенденцию к несущественному снижению. Однако, при более детальной оценке, выявлены достоверные различия (р<0,05) между данными полученными до лечения и в сроки контроля эрадикации в зависимости от наличия стигм дисэмбриогенеза, характерных для НДСТ. Этот факт можно объяснить с одной стороны цитопротекторным эффектом препарата коллоидного висмута в антихеликобактерной схеме, а с другой стороны — большим процентом больных с неопределёнными атрофиями при НДСТ.

Рис. 2. Динамика атрофии антрального отдела желудка на фоне лечения у пациентов основной и контрольной групп в зависимости от наличия или отсутствия НДСТ.
Примечание. * — достоверная разница с аналогичным показателем (р<0,05) полученным до лечения.
Положительные изменения гистологической картины у пациентов основной группы свидетельствуют о высокой цитопротекторной эффективности назначенной антихеликобактерной схемы, которая состоит из эзомепразола, амоксициллин, кларитромицина и коллоидного висмута. Полученные данные свидетельствуют о беспорной патогенетической роли дисплазии соединительной ткани в развитии и прогрессировании атрофических изменений, наряду с хеликобактерной инфекцией.
Выводы исследования
Учитывая высокий процент атрофических изменений слизистой оболочки желудка у больных с признаками НДСТ рекомендуется проводить оценку эрадикации инвазивными методами и дифференцировать истинные атрофии и неопределённые атрофии после курса антихеликобактерной терапии с обязательным использованием препарата коллоидного висмута.
Литература:
1. Аруин Л. И. Международная классификация хронического гастрита: что следует принять и что вызывает сомнения / Л. И. Аруин, А. В. Кононов, Мозговой С. И. // Арх. пат. — 2009. — Вып. 4. — С. 11–18.
2. Земцовский Э. В. Малые аномалии сердца и диспластические фенотипы / Э. В. Земцовский, Э. Г. Малев // СПб.: Изд-во «ИВЭСЭП»,2011. — 160 с.
3. Кононов А. В. Морфогенез атрофии слизистой оболочки желудка как основа фенотипа хронического гастрита / А. В. Кононов, С. И. Мозговой, М. В. Маркелова, А. Г. Шиманская //Арх. пат. — 2011. — Вып. 3. — С. 26–31.
4. Наследственные нарушения соединительной ткани. Российские рекомендации, разработанные комитетом экспертов Всероссийского научного общества кардиологов. — Москва, 2012. — 76с.
5. Beighton P. Ehlers-Danlos syndromes: Revised nosology, Villefranche, 1997/ P. Beighton, A. De Paepe, B. Steinmann, P. Tsipouras, R. J. Wenstrup //American Journal of Medical Genetics. — 1998. — Vol. 77, № 1. — Р. 31–37.
6. Grahame R., Bird H. A., Child A. The revised (Brighton, 1998) criteria for the diagnosis of benign joint hypermobility syndrome (BJHS) /R. Grahame, H. A. Bird, A. Child // Journal of Rheumatology. — 2000. — Vol. 27, № 7. — Р. 1777–1779.
7. Goldenring J. R. Oxyntic atrophy, metaplasia, and gastric cancer /J. R. Goldenring, K. T. Nam // Prog. Mol. Biol. Transl. Sci. — 2010. — Vol. 96. — P. 117–131.
8. Rugge M. OLGA staging for gastritis: a tutorial / M. Rugge, P. Correa, F. Di Mario et al. // Dig. Liver Dis. — 2008. — Vol. 40, № 8. — P. 650–658.
Основные термины (генерируются автоматически): соединительная ткань, контрольная группа, воспалительный процесс, коллоидный висмут, основная группа, отдел, больной, изменение, пациент, недифференцированная дисплазия.
Источник
Нарушения пищеварения и всасывания в кишечнике в процессе развития белково-энергетической недостаточности у пациентов с дисплазией соединительной ткан | #02/14 | «Лечащий врач» – профессиональное медицинское издание для врачей. Научные статьи.
Пристальное внимание к избыточной массе тела у пациентов нередко отвлекает врача от такой не менее важной проблемы, как состояние пониженного питания. При оценке прогноза течения заболевания не всегда учитывается наличие дефицита массы тела, питательной недостаточности, степень метаболических нарушений. Существенная роль в развитии белково-энергетической недостаточности принадлежит процессам нарушенного пищеварения и всасывания в кишечнике.
У пациентов с дисплазией соединительной ткани (ДСТ) признаки белково-энергетической недостаточности регистрируются чаще, чем в среднем по популяции [1]. Являясь фоновым заболеванием, ДСТ определяет многообразие морфофункциональных нарушений различных систем органов.
Процесс пищеварения складывается из последовательно сменяемых этапов работы «пищеварительно-транспортного конвейера» [2]:
- полостного пищеварения;
- пристеночного пищеварения;
- всасывания, внутриклеточного пищеварения и транспорта нутриентов во внутреннюю среду организма.
Нарушения полостного пищеварения (мальдигестия) и всасывания (мальабсорбция) развиваются при различных патологических процессах в желудке, двенадцатиперстной кишке (ДПК), поджелудочной железе, печени, желчевыводящих путях (ЖВП), тонком кишечнике, как органической, так и функциональной природы, и могут захватывать звенья пищеварительной системы как в отдельности, так и комбинированно, тотально, приводя, в конечном итоге, к развитию белково-энергетической недостаточности (рис. 1).
_575.gif)
Нарушения полостного пищеварения в кишечнике сопровождают любые моторные нарушения органов пищеварения (как гипер-, так и гипомоторные), встречаются как при недостаточности желудочной секреции, так и при избыточном «закислении» кишечника, недостаточной стимуляции нейропептидной системы и при ее повышенной реактивности. Вторичные воспалительные процессы усугубляют кишечное пищеварение и всасывание. При этом чем выраженнее нарушения пищеварения в кишечнике, тем отчетливее страдает моторная и пищеварительная функция желудка, печени, билиарного аппарата, поджелудочной железы — формируется «порочный круг».
За расстройством полостного пищеварения следуют нарушения пристеночного гидролиза, снижение всасывания нутриентов, витаминов, микроэлеменов, прогрессирует белково-энергетическая недостаточность.
Структурно-функциональные основы мальдигестии у пациентов с ДСТ
Дезорганизация соединительной ткани серозной оболочки, продольного и кругового мышечных слоев, подслизистой, слизистой оболочки полых органов, образующих единый соединительнотканный остов, обусловливает анатомическую вариабельность органов на фоне ДСТ. Аномальные триммеры коллагена чрезвычайно чувствительны к механическим нагрузкам. Изменения размеров, длины органов пищеварения, как правило, рано и в значительной степени отражаются на изменении их функции, снижении сократительной способности с развитием разнообразных гастроэнтерологических синдромов.
Пищеварительная система у пациентов с ДСТ имеет свои анатомические особенности [4]:
- Диспластикозависимые изменения со стороны полости рта: высоко расположенное небо, неправильное расположение, скученность зубов, неправильный прикус.
- Диспластикозависимые изменения сфинктерного аппарата.
- Диспластикозависимые нарушения фиксации органов (птоз органов): гастроптоз, гепатоптоз, колоноптоз.
- Диспластикозависимые изменения размеров, длины полых органов (приобретенные в течение жизни): мегаколон, долихосигма, удлиненный желчный пузырь, желудок в форме «чулка».
- Диспластикозависимые изменения стенки полых органов с развитием дивертикулов (приобретенные в течение жизни): дивертикулы пищевода, желудка, тонкого и толстого кишечника.
- Грыжи (паховая, бедренная, пупочная, диафрагмальная грыжа, грыжа передней брюшной стенки).
- Аномалии развития органов пищеварения.
Функциональные расстройства органов пищеварения у пациентов с ДСТ характеризуются манифестностью, разнообразием и персистенцией клинической симптоматики, высокой частотой гипомоторных нарушений и рефлюксов [5–11]. В основе моторно-тонических расстройств и клинических проявлений у лиц с ДСТ лежит комплекс диспластикозависимых анатомических изменений пищеварительной системы (анатомическая вариабельность органов, недостаточность сфинктеров). Наличие гастроэнтерологических жалоб и фенотипических признаков ДСТ (астенический тип конституции, наличие торакодиафрагмального синдрома и др.) должно послужить поводом для проведения углубленного исследования органов пищеварения с целью уточнения причины выявленных расстройств.
Кровоснабжение органов пищеварения у пациентов с ДСТ, имеющих дефицит массы тела, отличается более низким объемным кровотоком в системе спланхнитического кровообращения, что в свою очередь усугубляет всасывание и усвоение нутриентов, витаминов и микроэлементов [12].
Терапевтические аспекты
Консервативная терапия включает:
- коррекцию моторно-тонических нарушений органов пищеварения;
- нормализацию желчеотделения;
- восстановление микробиоценоза кишечника;
- заместительную ферментную терапию;
- коррекцию белково-энергетической недостаточности, гиповитаминоза, дефицита микроэлементов).
Всем пациентам рекомендуется диета с частым дробным питанием, при наличии спланхноптоза — ношение лечебного бандажа.
Для устранения гипомоторно-гипокинетических расстройств показаны прокинетики (домперидон, итоприд) в стандартных дозах, длительность терапии — до 1 месяца, курсами 2–3 раза в год и/или неселективный агонист опиоидных рецепторов (тримебутин). При наличии запоров показан энтерокинетик прукалоприд.
При наличии аномалий желчного пузыря, гипомоторной дискинезии желчевыводящих путей целесообразно применение препаратов урсодезоксихолевой кислоты. Помимо холеретического действия препараты нормализуют биохимические свойства желчи, конкурентно снижая всасывание гидрофобных (токсичных) желчных кислот в кишечнике, повышают фракционный оборот при энтерогепатической циркуляции, увеличивают концентрацию желчных кислот в желчи, угнетая рост протеолитической кишечной флоры, усиливают желудочную и панкреатическую секрецию, активность липазы, уменьшая проявления относительной панкреатической недостаточности. Образование нетоксичных смешанных мицелл снижает повреждающее действие желудочного рефлюктата на клеточные мембраны при билиарных дуоденогастральных и гастроэзофагеальных рефлюксах. При дискинезии желчевыводящих путей по гипокинетическому типу (и отсутствии диареи) средняя суточная доза — 10 мг/кг в 2 приема в течение от 2 недель до 2 мес. При необходимости курс лечения рекомендуется повторить. При билиарном рефлюкс-гастрите и рефлюкс-эзофагите — по 250 мг/сут перед сном. Лечение от 10–14 дней до нескольких месяцев, курсами.
Наличие синдрома избыточного бактериального роста в кишечнике является обоснованием для назначения антибактериальных препаратов (рифаксимин 200 мг 3–4 раза в сутки 7 дней). Угнетение роста протеолитической флоры сопровождается снижением процессов гниения, подавлением избыточной продукции бактериальных метаболитов, уменьшением выраженности вторичной панкреатической недостаточности. После антибактериальных препаратов назначаются про- и пребиотики. У пациентов с синдромом запора целесообразно назначение лактулозы. При наличии диареи — Saccharomyces boulardii, РиоФлора Баланс, Хилак форте в стандартных дозах. Про- и пребиотики обладают трофическим (стимулирует ферментативную активность кишечных дисахаридаз) и иммуномодулирующим действием. Критериями эффективности терапии являются: улучшение общего состояния, купирование метеоризма, нормализация стула и микробиологических показателей.
Дефицит массы тела, диарея, диспепсические расстройства являются показанием для назначения поликомпонентных ферментных препаратов. Для коррекции диспепсических проявлений, как правило, достаточно использование невысоких доз (до 10 тыс. ЕД липазы) с каждым приемом пищи продолжительностью 2 недели, курсами. Показаниями для назначения препарата Мезим форте у пациентов с ДСТ являются: недостаточность внешнесекреторной функции поджелудочной железы, хронические воспалительно-дистрофические заболевания желудка, кишечника, печени и желчного пузыря. Следует подчеркнуть, что преимуществом препарата Мезим форте перед другими ферментными лекарственными средствами является наличие нескольких лекарственных форм, содержащих соответственно 3 500 ЕД липазы, 10 0000 ЕД липазы и 20 000 ЕД липазы, что позволяет подбирать дозу препарата индивидуально, в зависимости от тяжести расстройства пищеварения. Возможность титрования и подбора минимально необходимой дозы препарата с учетом клинической ситуации позволяет предотвратить развитие функциональной хронической недостаточности поджелудочной железы при использовании высокодозных ферментных препаратов (10 000 ЕД липазы, 25 000 ЕД липазы).
При сохранении энергонутритивного дисбаланса (дисбаланса между потребностями, уровнем поступления и усвоения нутриентов) решить проблему адекватного потребления нутриентов при обычном рационе у ряда пациентов указанными мерами не удается. Наличие синдрома мальабсорбции обосновывает применение препаратов для дополнительного энтерального питания. Предпочтительным является использование полуэлементных смесей (Нутридринк), состоящих из беловых гидролизатов-олигопептидов, ди- и моносахаридов, триглицеридов с длинными и средними углеводородными цепочками, микроэлементов, витаминов.
В 2001 г. Американским обществом клинического питания был представлен метаанализ 90 исследований, 50 из которых были рандомизированными клиническими (РКИ), по использованию дополнительного энтерального питания у пациентов с белково-энергетической недостаточностью различного генеза [13]. В пяти исследованиях (6%, 2 РКИ) отмечено снижение смертности, в 38 исследованиях (42%, 22 РКИ) — улучшение функциональных возможностей, в 64 исследованиях (71%, 35 РКИ) — улучшение антропометрических и биохимических показателей.
Применение ряда фармакологических препаратов (гормона роста и/или анаболических стероидов) нецелесообразно в свете недавнего сообщения о повышенной смертности у тяжелобольных пациентов, получавших гормон роста [14–15].
Таким образом, диспластикозависимые структурно-функциональные особенности пищеварительной системы и висцеральной гемодинамики могут рассматриваться в качестве одной из причин прогрессирования белково-энергетической недостаточности у пациентов с ДСТ. Разнообразие гастроэнтерологических синдромов, многокомпонентность патогенетических механизмов нарушений пищеварения у пациентов с ДСТ требуют особого, взвешенного подхода к курации данной категории пациентов.
Литература
- Лялюкова Е. А. Белково-энергетическая недостаточность у пациентов с дисплазией соединительной ткани // Клиническая и экспериментальная гастроэнтерология. 2013.
- Уголев А. М. Физиология и патология пристеночного (контактного) пищеварения. Л., 1967. 124 с.
- Маев И. В. Панзинорм форте-Н — эффективное средство для адекватной терапии синдрома мальдигестии/мальабсорбции // Сonsilium medicum. 2005. Том 07. № 1. C. 12–17.
- Лялюкова Е. А., Рожкова М. Ю. Дисплазия соединительной ткани: основные гастроэнтерологические проявления // Клиническая и экспериментальная гастроэнтерология. 2010. № 6. С. 66–69.
- Беляева Е. Л. Некоторые гастроэнтерологические аспекты соединительнотканныхных дисплазий: Сб. научных статей. СПб: Изд-во СПб ГМА, 2001. С. 188.
- Богмат Л. Ф., Савво В. М. Состояние верхних отделов желудочно-кишечного тракта у подростков с системной дисплазией соединительной ткани сердца. Материалы VIII конференции «Актуальные проблемы абдоминальной патологии у детей». М., 2001. С. 3–4.
- Смирнова Е. В. Состояние системы гемостаза и особенности клинического течения хронического гастродуоденита у детей с дисплазией соединительной ткани: Автореф. дис. … канд. мед. наук. Томск, 2007. 38 с.
- Солодовник А. Г., Мозес К. Б. Роль дисплазии соединительной ткани в формировании гастро-дуоденальной патологии у подростков // Актуальные вопросы внутренней патологии. Дисплазия соединительной ткани: материалы 1 всерос. науч. практ. конф. Омск, 2005. С. 71–72. (Прил. к журн. «Омский научный вестник»; № 5 (32)).
- Клеменов А. В. Внекардиальные проявления недиференцированной дисплазии соединительной ткани // Клин. медицина. 2003; 81 (10): 4–7.
- Лебеденко Т. Н. Клинико-морфологическая характеристика хеликобактер-ассоциированного гастрита у больных с дисплазией соединительной ткани: дис. … канд. мед. наук. Омск, 1999. 157 с.
- Осипенко М. Ф. Аномалии ободочной кишки у взрослых: распространенность, клиника, диагностика, подходы к терапии. Новосибирск, 2005, 160 с.
- Лялюкова Е. А., Ливзан М. А., Орлова Н. И. Особенности абдоминальной гемодинамики у пациентов астенической конституции со спланхноптозом // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. Материалы 17-й Российской гастроэнтерологической недели 10–12 октября. Москва, 2011 г. Т. ХХI, № 5. С. 180.
- Akner G., Cederholm T. Treatment of protein-energy malnutrition in chronic nonmalignant disorders // Am J Clin Nutr. 2001, July, 74: 6–24.
- Spallarossa P., Rossettin P., Minuto F. et al. Evaluation of growth hormone administration in patients with chronic heart failure secondary to coronary artery disease // Am J Cardiol. 1999; 84: 430–433.
- Takala J., Ruokonen E., Webster N. R. et al. Increased mortality associated with growth hormone treatment in critically ill adults // N Engl J Med. 1999; 341: 785–792.
Е. А. Лялюкова, кандидат медицинских наук
ГБОУ ВПО ОмГМА МЗ РФ, Омск
Контактная информация: Lyalykova@rambler.ru
Abstract. Protein-calorie deficiency is typical for patients with alimentary organ pathology. The cause of its development is disturbances of intestinal digestion and absorption. Mechanisms of protein-calorie deficiency of patients with conjunctive tissue dysplasia and approaches to therapy are reviewed in the article.
Источник