Диета для ребенка с колитом
Содержание статьи
Колит у детей
Колит у детей — полиэтиологическое заболевание толстой кишки, сопровождающееся ее воспалительно-дистрофическими изменениями. Колит у детей протекает с болями в животе, тошнотой, изменением частоты и характера стула, недомоганием. Диагностика колита у детей включает копрологическое и бактериологическое исследование кала, проведение ирригографии, ректосигмоскопии и колоноскопии, эндоскопической биопсии слизистой кишки. Лечение колита у детей во многом зависит от его патогенетической формы и включает диетотерапию, антибактериальную и симптоматическую терапию, фитотерапию, восстановление нормальной кишечной микрофлоры.
Общие сведения
Колит у детей — воспаление толстого кишечника, характеризующееся болями и функциональными нарушениями со стороны толстой кишки. Не менее 10% всех случаев хронического колита начинается в детском возрасте, поэтому заболевания толстой кишки, их диагностика и лечение составляют одну из сложных проблем детской гастроэнтерологии. В силу анатомо-физиологических особенностей пищеварительной системы детей раннего возраста, воспалительный процесс, как правило, протекает с одновременным вовлечением тонкой и толстой кишки (энтероколит). У детей школьного возраста обычно встречается изолированное поражение различных отделов кишечника — энтерит и колит.
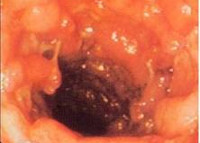
Колит у детей
Причины колита у детей
Острый колит у детей, как правило, развивается на фоне кишечной инфекции (сальмонеллеза, шигеллеза, эшерихиоза, иерсиниоза, пищевой токсикоинфекции, ротавирусной инфекции и др.) и в большинстве случаев сочетается с острым гастритом, острым энтеритом или гастроэнтеритом. Иногда причиной острого колита у детей выступают индивидуальная непереносимость некоторых компонентов пищи, грубые нарушения диеты, радиационное воздействие.
Хронический колит может являться исходом острого колита (например, при дизентерии у детей), а также развиваться вследствие глистных и паразитарных заболеваний (аскаридоза, лямблиоза), систематического нарушения пищевого режима, воздействия бытовых ядовитых агентов, нерационального применения лекарственных препаратов (НПВС, антибиотиков, слабительных и др.), секреторной недостаточности пищеварительных желез (врожденных и приобретенных энзимопатий — целиакии и дисахаридазной недостаточности), дисбактериоза и пр.
Реализации воспаления слизистой кишечника способствуют психогенные факторы, вегето-сосудистая дистония у детей, отягощенная наследственность, врожденные особенности развития кишечника (долихосигма, мегаколон), малоподвижный образ жизни, вредные привычки в подростковом возрасте. Вторичные колиты у детей встречаются при эндокринных заболеваниях (гипотиреозе, микседеме), заболеваниях ЦНС (миастении, детском церебральном параличе).
Классификация
Воспалительные изменения в толстой кишке могут быть распространенными либо ограниченными одним или несколькими сегментами. В соответствии с этим выделяют изолированное воспаление слепой кишки (тифлит); воспаление слепой и восходящей кишки (тифлоколит); воспаление поперечно-ободочной кишки (трансверзит); воспаление перехода поперечно-ободочной кишки в нисходящую (ангулит); воспаление сигмовидной кишки (сигмоидит); воспаление прямой и сигмовидной кишки (проктосигмоидит); воспаление прямой кишки (проктит); генерализованное воспаление (панколит).
С учетом этиологического фактора колиты у детей бывают инфекционными, алиментарными, паразитарными, токсическими, медикаментозными, лучевыми, невротическими, вторичными, невыясненной этиологии.
На основании эндоскопической картины и морфологических признаков выделяют катаральный, атрофический и эрозивно-язвенный колит у детей. По характеру клинического течения колиты у детей делятся на острые и хронические; по типу течения — на монотонные, рецидивирующие, прогрессирующие, латентные; по тяжести течения — на легкие, средней тяжести, тяжелые.
В зависимости от состояния моторики толстой кишки и преобладающих функциональных нарушений кишечника различают колиты у детей с преобладанием запоров или поносов, сменой запоров и поносов. В клиническом течении колита у ребенка выделяют фазу обострения, клинической ремиссии, клинико-эндоскопической (гистологической) ремиссии.
Основные клинические формы колитов, встречающиеся у детей, представлены острым колитом, хроническим колитом, неспецифическим язвенным колитом, спастическим колитом.
Симптомы колита у детей
Острый инфекционный колит протекает на фоне выраженного токсикоза и эксикоза: повышенной температуры, анорексии, слабости, рвоты. В результате спазма кишечника ребенка беспокоят боли в подвздошной области, тенезмы. Стул учащается от 4-5 до 15 раз в сутки; испражнения имеют водянистый, пенистый, характер; зеленоватый цвет, примесь слизи и прожилок крови. Во время дефекации может отмечаться выпадение прямой кишки. При осмотре ребенка с острым инфекционным колитом обращают внимание признаки обезвоживания: снижение тургора тканей, сухость слизистых, заострение черт лица, олигурия.
Хронический колит у детей имеет волнообразное течение с чередованием обострений и ремиссий. Основными клиническими проявлениями колита у детей служат болевой синдром и нарушение стула. Боли локализуются области пупка, правой или левой подвздошной области; имеют ноющий характер; возникают после приема пищи, усиливаются во время движений или перед дефекацией.
Расстройство стула при хроническом колите у детей может выражаться диареей, запорами или их чередованием. Иногда отмечается учащение позывов на дефекацию (до 5-7 раз в сутки) с выделением кала различного характера и консистенции (жидкого, со слизью или непереваренной пищей, «овечьего» или лентовидного кала и т. д.). Запор у детей с последующим отхождением твердых каловых масс может приводить к образованию трещин заднего прохода и появлению небольшого количества алой крови в стуле.
Дети с хроническим колитом жалуются на вздутие и распирание живота, урчание в кишечнике, усиленное отхождение газов. Иногда в клинике колита у детей доминируют психовегетативные расстройства: слабость, утомляемость, раздражительность, нарушение сна, головная боль. Длительное течение колита у детей может приводить к задержке прибавки массы тела и роста, анемии, гиповитаминозу.
Хронический колит у детей требует дифференциации с целиакией, муковисцидозом, дискинезией кишечника, хроническим аппендицитом, энтеритом, дивертикулитом, болезнью Крона.
Диагностика
Постановка диагноза основывается на данных анамнеза, клинической картины, физикального, лабораторного, инструментального (рентгенологического, эндоскопического) обследования.
При исследовании крови у детей, страдающих колитами, обнаруживается анемия, гипоальбуминемия, снижение уровня электролитов в сыворотке крови. Копрологическое исследование выявляет наличие в кале лейкоцитов, слизи, стеатореи, амилореи, креатореи. Бактериологическое исследовании кала позволяет исключить инфекционную природу острого и хронического колита у детей. Анализ кала на дисбактериоз, как правило, демонстрирует изменение микробного пейзажа кишечника за счет возрастания условно-патогенных агентов — стафилококков, протея, кандид.
При эндоскопическом исследовании кишечника (колоноскопии, ректоскопии) у детей чаще выявляется картина катарального колита: слизистая оболочка толстой кишки гиперемирована, отечна; лимфоидные фолликулы увеличены; обнаруживается большое количество слизи, точечные кровоизлияния, ранимость слизистой при контакте. Эндоскопическая биопсия слизистой кишки и морфологическое исследование биоптата способствуют дифференциальной диагностике различных форм колита у детей.
С целью уточнения степени и тяжести воспаления при колите у детей выполняется ирригография. Для изучения функционального состояния толстой кишки проводится рентгенография пассажа бария.
Лечение колита у детей
Лечение колита у детей направлено на элиминацию возбудителя, восстановление функции кишечника, предупреждение рецидива или обострения. Во всех случаях колита у детей назначается механически и химически щадящая диета: некрепкие бульоны, слизистые отвары, паровые блюда, омлеты, каши, кисели. Терапия острого инфекционного колита у детей проводится по правилам лечения кишечных инфекций (антибиотикотерапия, оральная регидратация, прием бактериофагов, энтеросорбентов и т. д.).
При хроническом колите у детей, кроме лечебного питания, показан прием ферментных препаратов (панкреатин), пребиотиков и пробиотиков, энтеросорбентов, прокинетиков (лоперамид, тримебутин). Антибактериальные препараты назначаются по строгим показаниям. В рамках терапии колита детям рекомендуется употребление минеральной воды без газа, настоев и отваров лекарственных трав. При необходимости в комплекс терапевтических мероприятий включают ИРТ, физиотерапию (электрофорез, грязелечение, согревающие компрессы на область живота), массаж живота и лечебную гимнастику.
Прогноз и профилактика
В случае своевременного лечения и полноценной реабилитации острый колит у детей заканчивается клинико-лабораторным выздоровлением. При хроническом колите у детей соблюдение рекомендуемого режима обеспечивает продолжительную ремиссию. Частые обострения колита нарушают физическое развитие детей, их психосоциальную адаптацию.
Профилактика колита у детей предполагает соблюдение возрастной диеты и режима питания, полноценное лечение острых кишечных инфекций, глистных инвазий, дисбактериоза. Диспансерное наблюдение детей проводится педиатром и детским гастроэнтерологом. Проведение профилактических прививок разрешается в период стойкой ремиссии хронического колита у детей.
Источник
Использование лечебного питания в комплексной терапии хронических воспалительных заболеваний кишечника у детей
 Неспецифический язвенный колит и болезнь Крона остаются одной из наиболее серьезных проблем в современной гастроэнтерологии, так как характеризуются тяжелым течением, частыми рецидивами, развитием местных и системных осложнений, неблагоприятным прогнозом и инвалидизацией. У пациентов с хроническими воспалительными заболеваниями кишечника (ВЗК) также имеют место изменения нутритивного статуса, связанные с дефицитом белка, макро- и микроэлементов, энергетических субстратов. В педиатрической практике эта проблема особенно актуальна, так как питание является не только одним из важных факторов, определяющих адекватность течения воспалительного ответа и адаптационно-компенсаторных процессов, но также играет ключевую роль в процессах роста и развития больного ребенка.
Неспецифический язвенный колит и болезнь Крона остаются одной из наиболее серьезных проблем в современной гастроэнтерологии, так как характеризуются тяжелым течением, частыми рецидивами, развитием местных и системных осложнений, неблагоприятным прогнозом и инвалидизацией. У пациентов с хроническими воспалительными заболеваниями кишечника (ВЗК) также имеют место изменения нутритивного статуса, связанные с дефицитом белка, макро- и микроэлементов, энергетических субстратов. В педиатрической практике эта проблема особенно актуальна, так как питание является не только одним из важных факторов, определяющих адекватность течения воспалительного ответа и адаптационно-компенсаторных процессов, но также играет ключевую роль в процессах роста и развития больного ребенка.
Дети, страдающие этой тяжелой хронической патологией, как правило, имеют дефицит массы тела с уменьшением подкожно-жировой клетчатки и снижением тургора тканей (по нашим данным, отмечается у 40,3% детей с неспецифическим язвенным колитом и у 54,2% детей с болезнью Крона) [1], часто наблюдается отставание в росте, задержка полового созревания, снижение минерализации костной ткани.
Нарушения нутритивного статуса при хронических воспалительных заболеваниях кишечника обусловлены рядом причин:
недостаточным поступлением питательных веществ в организм ребенка в результате:
уменьшения всасывательной поверхности слизистой оболочки из-за воспалительного процесса или резекции части кишечника;
ферментативной недостаточности (синдром мальабсорбции, синдром «короткой кишки»);
отсутствия аппетита или отказа от приема пищи ввиду болей в животе, возникающих после еды, метеоризма, тошноты;
повышенными потерями питательных веществ (хроническая кровопотеря, обусловленная выделением крови с калом, экссудация кишечником белков плазмы крови);
увеличением энергозатрат в связи с развитием системного воспалительного процесса (повышение температуры тела, увеличение частоты пульса и дыхания, синтез белков «острой фазы»).
Кроме того, усилению катаболических процессов способствует гиперпродукция мононуклеарами крови провоспалительных цитокинов или длительная терапия кортикостероидами [5].
Коррекция нутритивных нарушений обеспечивается назначением адекватного лечебного питания, которое необходимо рассматривать как одно из основных направлений в составе комплексной терапии хронических воспалительных заболеваний кишечника у детей.
Лечебное питание должно строиться с учетом возраста ребенка, нозологии, фазы патологического процесса, характера функциональных и морфологических изменений кишечника, сочетанной патологии органов пищеварения.
Общепризнанной формулы диетического питания при ВЗК у взрослых пациентов и у детей не существует [3, 4]. Задача врача состоит в том, чтобы подобрать больному индивидуальную диету, которая не вызывала бы у него неприятных субъективных ощущений и способствовала бы сохранению длительной ремиссии. Рекомендуется ведение пищевого дневника родителями больного ребенка с учетом рациона и характера стула для своевременной диагностики непереносимости отдельных продуктов и диетической коррекции.
В условиях стационара при обострении неспецифического язвенного колита и болезни Крона у детей рекомендуется лечебный рацион на основе диеты № 4б.
Адекватное поступление нутриентов и энергии можно обеспечить путем энтерального и парентерального питания.
Возможность использования полного парентерального питания как первичного метода лечения и его способность уменьшить активность тяжело протекающего язвенного колита и болезни Крона у детей остается недостаточно изученной. Парентеральное питание применяется как дополнительное в случаях выраженной недостаточности питания или как полное при наличии таких осложнений, как кишечная непроходимость, токсическая дилятация толстой кишки, тяжелые нарушения всасывания [7].
В отличие от парентерального питания, проведение нутритивной поддержки с помощью энтерального питания является более физиологическим методом, так как способствует поддержанию функции желчеотделения и поджелудочной железы, служит стимулом для выработки гастроинтестинальных пептидов, способствует восстановлению всасывательной и моторно-эвакуаторной функций кишечника и сохранению защитного барьера, отделяющего патогенные микроорганизмы от системной микроциркуляции.
Энтеральное питание с использованием стандартных диет применяется в качестве самостоятельного метода лечения, а также в комбинации с лекарственной терапией. Последние исследования показали высокую эффективность энтерального питания, применение которого приводит не только к коррекции дистрофических нарушений и дефицитных состояний, но и обеспечивает индукцию ремиссии не менее эффективно, чем введение глюкокортикостероидов при лечении болезни Крона у детей [8, 9].
Выделяют три группы смесей для энтерального питания: элементные (смеси на основе аминокислот), полуэлементные (содержащие олигопептиды) и полимерные (высокомолекулярные смеси на основе цельного белка).
Новым перспективным направлением является лечебное питание с использованием так называемых иммуномодулирующих продуктов, примером которых является специально разработанная для пациентов с хроническими воспалительными заболеваниями кишечника смесь Modulen IBD (Nestle). Смесь обогащена естественным противовоспалительным фактором роста (TGF-бета2) — полипептидом, который участвует в обеспечении роста и дифференцировки эпителиальных клеток кишечника, а также в иммунной регуляции, подавляя синтез провоспалительных цитокинов. Этот полипептид обнаруживается как в женском, так и в коровьем молоке, но разрушается при обычных способах его обработки. Содержание TGF-бета2 в смеси составляет более 24 ppm. Белковый компонент продукта представлен казеинами; углеводный — полимерами глюкозы и сахарозой; жировой: смесью молочного жира, кукурузного масла и среднецепочечными триглицеридами. Продукт содержит адекватное количество витаминов, минеральных веществ. Смесь не содержит лактозу и глютен, может применяться у детей с 5-летнего возраста.
Высокая эффективность энтерального питания с использованием полимерной смеси Modulen IBD (Nestle) детям с болезнью Крона продемонстрирована в двух исследованиях.
В первом проспективном исследовании 29 пациентов с тяжелой и среднетяжелой формой болезни Крона получали смесь в качестве монотерапии и единственного источника питания на протяжении 8 недель. За исключением одного ребенка, все дети принимали индивидуально рассчитанный объем смеси (в среднем 2500 мл) перорально с хорошей переносимостью. Была достигнута положительная клиническая и биохимическая динамика (снижение С-реактивного белка), улучшение эндоскопической и гистологической картины со стороны слизистой оболочки кишечника, а также достоверное снижение уровня провоспалительных цитокинов (интерлейкина-1, интерлейкина-8, интерферона-альфа) в биоптатах подвздошной и толстой кишки, что позволило достигнуть длительной ремиссии у 75% детей [10].
Во втором открытом, проспективном, рандомизированном исследовании 19 пациентов с активной болезнью Крона получали полимерную диету Modulen IBD в течение 10 недель и 18 пациентов метилпреднизолон внутрь (1,6 мг/кг/день в течение четырех недель, с последующим снижением дозы). Было показано, что нутритивная терапия так же эффективна в индукции клинической ремиссии, как и короткий курс кортикостероидной терапии, и достоверно более эффективна для восстановления слизистой, что было подтверждено эндоскопически и гистологически через 10 недель от начала терапии [8].
С целью коррекции нутритивного статуса смесь лечебного питания может быть использована на фоне базисной терапии дополнительно к лечебному столу.
На базе нашего института мы имеем опыт применения смеси Modulen IBD в качестве дополнительного питания. Смесь назначалась в дозе 200-600 мл в сутки (в среднем, по 150 мл на второй завтрак и полдник) в течение 3-6 недель дополнительно к безмолочному диетическому столу (№ 4 по Певзнеру). Под наблюдением находилось 24 ребенка в возрасте от 2 до 17 лет (средний возраст 12,3 года). Десять пациентов с неспецифическим язвенным колитом и четырнадцать с болезнью Крона. Четверо детей были в послеоперационном периоде, оперативное вмешательство выполнялось в связи с развитием осложнения болезни Крона (стенозирование кишки). До назначения лечебного питания физическое развитие было нормальным лишь у 5 пациентов, остальные наблюдавшиеся имели дефицит массы тела (табл.).
При использовании Modulen IBD у 22 из 24 пациентов была отмечена хорошая переносимость продукта. Отрицательная реакция на применение смеси была у мальчика 14 лет с неспецифическим язвенным колитом на 5-6 день приема в виде появления примеси крови в кале, которая купировалась после ее отмены и назначения сорбентов. Еще у одной пациентки с болезнью Крона при употреблении смеси отмечено увеличение кратности стула с трех до пяти раз в день. Клинико-анамнестические данные у первого пациента позволяют связать реакцию с индивидуальной непереносимостью белка казеина. У всех детей, получавших смесь Modulen IBD полным курсом в составе комплексной терапии, отмечена положительная клиническая динамика в виде улучшения самочувствия, уменьшения выраженности астении, трофических нарушений, прибавки в массе от 500 г до 4 кг (в среднем 1,8 кг), уменьшения клинико-лабораторных показателей активности по основному заболеванию. Кроме того, имело место улучшение характера стула (снижение кратности до 1-2 раз в день, густая консистенция). Дополнительно следует отметить хорошие вкусовые качества смеси, что обеспечивает повышение аппетита, положительный эмоциональный настрой ребенка и заменяет в питании молоко детям, чувствующим себя ущербными на постоянной безмолочной диете.
Эффективность лечебного питания при болезни Крона можно продемонстрировать следующим клиническим наблюдением.
Пациент М, 16 лет, наблюдается в НИИ детской гастроэнтерологии с 11-летнего возраста, когда впервые у него была диагностирована болезнь Крона с множественной локализацией (в подвздошной кишке, сигмовидной кишке и аноректальной зоне). Пациент длительно получал терапию месалазином внутрь и ректально, топические стероиды (будесонид). В последующем течение заболевания приняло торпидный характер, по данным рентгенологического обследования выявлен стеноз подвздошной кишки с нарастанием по протяженности в течение года, в связи с чем произведено плановое оперативное лечение. Было удалено около 70 см подвздошной кишки с тремя участками стеноза, язвенным поражением, произведена резекция слепой кишки. После оперативного лечения длительно сохранялись явления сопутствующего пиелонефрита.
Мальчик получал постоянную поддерживающую терапию месалазином. В ноябре 2008 года при прохождении планового обследования в институте в статусе было отмечено: сниженная масса тела (рис.), нарушение осанки, выраженная сухость кожи, остаточные проявления герпетических высыпаний в области губ, хейлит. Живот безболезненный, мягкий. Аппетит сниженный, избирательный. Стул до трех раз в день, кашицеобразный, без видимых патологических примесей. Клинический анализ крови без воспалительных изменений. По данным колоноскопии воспалительных изменений в толстой кишке не было выявлено, анальные трещины эпителизированы. При проведении видеокапсульной эндоскопии выявлен тотальный эрозивно-язвенный процесс тонкой кишки, желудка, двенадцатиперстной кишки. В связи с отказом родителей от назначения стероидов ребенку было назначено дополнительное лечебное питание специализированной смесью Modulen IBD по 150-200 мл ´ 3 раза в день в течение 6 недель.
При повторном обследовании, несмотря на то, что по данным видеокапсульной эндоскопии положительной динамики на фоне лечения не было получено (сохранялся распространенный эрозивно-язвенный процесс), была отмечена положительная динамика в виде улучшения аппетита и самочувствия, купирования дистрофических изменений кожи, прибавки в массе 4,3 кг, восстановления индекса массы тела (19 кг/м2). Использование дополнительного лечебного питания специализированной смесью у данного больного позволило эффективно корректировать нутритивный статус пациента, даже в случае множественной локализации болезни Крона.
Смесь Modulen IBD может быть использована у детей с хроническими воспалительными заболеваниями кишечника в активной фазе заболевания, а также в послеоперационном периоде, за исключением пациентов, имеющих непереносимость казеина.
Таким образом, на современном этапе лечебное питание рассматривается как один из методов патогенетической терапии хронических воспалительных заболеваний кишечника. Диетотерапия должна строиться индивидуально с учетом возраста ребенка, нозологии, фазы патологического процесса, характера функциональных и морфологических изменений кишечника, сочетанной патологии органов пищеварения. Перспективным направлением представляется применение энтерального (зондового и сипингового) питания с использованием специализированных смесей, как в качестве дополнительной терапии к медикаментозному лечению с целью коррекции белково-энергетической недостаточности, так и в качестве эффективной монотерапии с целью индукции и поддержания ремиссии.
Литература
Богомолов А. Р. Клинические особенности заболеваний, протекающих с кровью в стуле у детей: Автореф. дис. … канд. мед. наук. Нижний Новгород, 2002. 22 с.
Bistrian B. Role of the systemic inflammatory response in the development of protein-energy malnutrition in Inflammatory bowel disease // Inflammatory Bowel Diseases: Nestle Nutrition Workshop Series Clinical & Performance Programme. 1999. V. 2, p. 1-6.
Адлер Г. Болезнь Крона и язвенный колит. Перевод с нем. М.: Гоэтар-Мед, 2001. С. 296-303; 427-429.
Беренс Р., Будерус Ш., Келлер К.-М., фон дер Остен-Сакен И. Болезнь Крона и язвенный колит у детей и подростков. Практическое руководство. Dr. Falk Pharma GmbH. 2005. С. 46.
Каншина О. А., Каншин Н. Н. Неспецифический язвенный колит у детей (и врослых) М.: Биоинформсервис, 2002. 212 с.
Рославцева Е. А., Боровик Т. Э., Мазанкова Л. Н. Современные представления о лечебном питании при болезни Крона в детском возрасте // Вопросы детской диетологии. 2003. т. 1, № 2, с. 24-27.
Халиф И. Л., Лоранская И. Д. Воспалительные заболевания кишечника (неспецифический язвенный колит и болезнь Крона) клиника, диагностика и лечение. М.: Миклош, 2004. 88 с.
Borelli O. et аl. Polymeric Diet Alone Versus Corticosteroids in the Treatment of Active Pediatric Crohn’s Disease: A Randomized Controlled Open-Label Trial // Clinical Gastroenterologi and hepatologi. 2006. V. 4. № 6. P. 1-10.
Griffits A. Enteral nutrition in children // Inflammatory bowel disease. Nestle Nutrition Workshop Series, Clinical & Performance Programme. 1999. № 2. P. 31-33.
Fell J. M., Paintin M., Arnaud-Battandier F. et al. Mucosal healing and a fall in mucosal pro-inflammatory cytokine mRNA induced by a specific oral poly meric diet in paediatric Crohn’s disease // Aliment. Pharmacol. Ther. 2000. V. 14 (3). P. 281-289.
О. А. Тутина
Э. Н. Федулова, кандидат медицинских наук
Л. В. Бейер, доктор медицинских наук
О. В. Федорова, кандидат медицинских наук
НИИ детской гастроэнтерологии Росмедтехнологий, Нижний Новгород
Контактная информация об авторах для переписки: tutina_oa@mail.ru
Характеристика группы пациентов, получавших смесь лечебного питания Modulen IBD
Рис. Динамика клинических и эндоскопических параметров у пациента с болезнью Крона
Источник