Аутоиммунный метапластический гастрит эндоскопическая диагностика
Содержание статьи
Аутоиммунный метапластический гастрит
Аутоиммунный метапластический гастрит — это хронический воспалительный процесс слизистой оболочки желудка, приводящий к атрофии слизистой оболочки органа. Как правило, термин «аутоиммунный» означает нарушение работы иммунной системы — в крови циркулируют антитела к собственным клеткам и тканям пациента, соответственно, атакуют их.
Аутоиммунный гастрит связан с наличием антител, направленных против париетальных клеток желудка (эти клетки ответственны, среди прочего, за выработку соляной кислоты и внутреннего фактора, необходимого для поглощения витамина B12 в подвздошной кишке) и против внутреннего фактора.
Из-за повреждения подкладочных клеток происходит повышение кислотности желудочного сока и нарушение всасывания витамина В12.
Причины аутоиммунного метапластического гастрита остаются неясными, но есть некоторая генетическая предрасположенность. Кроме того, люди с аутоиммунными заболеваниями с большей вероятностью сосуществуют с другими аутоиммунными патологиями, и, например, аутоиммунный гастрит чаще связан с диабетом 1 типа, тиреоидитом Хашимото, синдромом Шегрена и другими заболеваниями.
В ходе аутоиммунного гастрита антитела против подкладочных клеток желудка связываются с механизмом, ответственным за производство соляной кислоты. Также наблюдаются воспалительные инфильтрации в слизистой желудка.
Поражения, типичные для аутоиммунного гастрита, находятся в желудочном стволе, в небольшой степени в пилорном отсеке (т.е. в переходе между желудком и двенадцатиперстной кишкой). По оценкам, аутоиммунный гастрит встречается примерно у 2-20% людей старше 50 лет.
Признаки и симптомы
Аутоиммунный метапластический гастрит остается бессимптомным в течение длительного времени. Симптомы связаны с развитием макроцитарной анемии (с так называемыми крупными клетками крови), которая возникает из-за дефицита витамина B12 .
Симптомы изначально неспецифичны — они могут встречаться при многих разных заболеваниях. Симптомы, возникающие при анемии, включают бледность (при анемии с дефицитом витамина B12 кожа имеет слегка желтоватый цвет и воскообразный вид). Пациенты жалуются на легкую усталость, слабость, иногда сонливость или плохую концентрацию. Анемия (независимо от причины) может привести к ощущению учащенного сердцебиения (тахикардия), а в более тяжелых случаях — к одышке.
Около половины людей с дефицитом витамина B12 испытывают потерю веса. Желудочно-кишечные симптомы, которые могут возникнуть при дефиците витамина B12 и, следовательно, при аутоиммунном гастрите, — это расстройства вкуса (дисгевзия), жжение языка, диспепсические симптомы (тошнота, чувство сытости, дискомфорт в животе).
Витамин B12 очень важен для правильного функционирования нервной системы, поэтому его недостаток приводит к появлению симптомов со стороны этой системы. Дефицит этого витамина вызывает, помимо прочего, чувство онемения в конечностях, покалывание в пальцах, ослабление мышечной силы, в более тяжелых случаях наблюдается нарушение зрения. При осмотре врач может обнаружить, что ослабели нервные рефлексы.
— Что делать, если вы испытываете симптомы аутоиммунного метапластического гастрита?
Симптомы, возникающие в ходе аутоиммунного гастрита и развития вторичной недостаточности витамина В12 , неспецифичны. Симптомы, указывающие на анемию, требуют подтверждения или исключения. В случае быстро усиливающихся симптомов необходима ускоренная диагностика.
Анемия (независимо от ее типа) требует объяснения ее причин. Внезапное появление неврологических симптомов (например, отсутствие ощущения в конечности, затруднение движений, асимметрия движений, парез, потеря зрения) требует срочной встречи с врачом, т.е. вызова бригады скорой помощи или обращения в больницу (пункт неотложной медицинской помощи).
Постоянные диспепсические симптомы (тошнота, рвота, отрыжка, чувство тяжести, дискомфорт или боль в животе) также требуют обращения к врачу общей практики для дальнейшей диагностики.
Причины
Заболевание вызвано атакой клеток иммунной системы собственных тканей в желудке. Однако ответ на вопрос, почему это происходит, неизвестен.
Ученые полагают, что причиной процесса может быть генетическая предрасположенность к так называемым аутоиммунным реакциям. Эта теория подтверждается исследованиями, которые показывают, что у пациентов с болезнью часто встречаются и другие аутоиммунные заболевания (тиреоидит, язвенный колит, ревматоидный артрит, сахарный диабет 1 типа, целиакия).
Диагностика
Аутоиммунный метапластический гастрит диагностируется на основании наличия антител и типичных микроскопических изменений в срезах слизистой оболочки желудка. Для сбора срезов тканей желудка необходимо выполнить гастроскопию (эндоскопическое исследование) .
При наличии неврологических симптомов и макроцитарной анемии необходимо определить концентрацию витамина B12 в крови. Определение макроцитарной анемии требует определения витамина B12 и фолиевой кислоты (вторая причина этого типа анемии) в крови. Пациенты с аутоиммунным метапластическим гастритом имеют антитела против париетальных клеток, против внутреннего фактора; также могут присутствовать антитела к собственному комплексу фактор-витамин B12.
Поскольку аутоиммунный гастрит связан с немного более высоким риском развития раковых поражений желудка, если есть постоянные или постоянные диспепсические симптомы или потеря веса, несмотря на лечение, пожалуйста, свяжитесь с врачом.
Лечение
Лечение аутоиммунного гастрита включает пожизненную парентеральную (т.е. оральную) добавку витамина B 12, если диагностируется анемия. К сожалению, нет возможности причинного лечения, потому что использование иммунодепрессантов, т.е. подавляющих образование антител против собственных тканей, неэффективно.
Витамин В12 является симптоматическим методом лечения и включается при развитии анемии. Вспомогательные методы имеют очень ограниченное значение. Из-за дефицита внутреннего фактора, необходимого для всасывания витамина B12 в дальнейших отделах желудочно-кишечного тракта, диетическое ведение бессмысленно.
Можно ли полностью вылечить аутоиммунный метапластический гастрит?
Невозможно полностью вылечить аутоиммунный гастрит. Диагноз требует периодической морфологии крови, иногда концентрации витамина В12 в крови и в случае анемии парентерального его замещения.
Аутоиммунный метапластический гастрит связан с повышенным риском развития аденокарциномы в 3-5 раз, поэтому необходимо регулярно посещать врача.
Источник
Аутоиммунный метапластический атрофический гастрит
Ресурсы по теме
Аутоиммунный метапластический атрофический гастрит – это наследственное аутоиммунное заболевание, поражающее париетальные клетки, что приводит к гипохлоргидрии и сниженной продукции внутреннего фактора. Последствия включают атрофический гастрит, мальабсорбцию витамина B12 и часто пернициозную анемию. При этом риск аденокарциномы желудка возрастает в 3 раза. Для диагноза необходима эндсокопия. Лечение проводится парентеральным введением витамина B12.
У больных с аутоиммунным метапластическим атрофическим гастритом (АМАГ) выявляют антитела к париетальным клеткам и их составляющим (включая внутренний фактор и протонную помпу Н+-, К+-АТФазу). Аутоиммунный метапластический атрофический гастрит наследуется аутосомно-доминантным путем. У некоторых больных развивается также тиреоидит Хашимото, а у 50% обнаруживаются антитела против тиреоидных клеток; и наоборот, антитела против париетальных клеток выявляются у 30% больных с тиреоидитом.
Гипохлоргидрия приводит к гиперплазии G-клеток и повышенному уровню гастрина в сыворотке крови (часто > 1 000 пг/мл). Повышенный уровень гастрина ведет к гиперплазии энтерохромаффиноподобных клеток, трансформация которых может закончится развитием карциноидной опухоли.
У некоторых больных аутоиммунный метапластический атрофический гастрит ассоциирован с хронической инфекцией Helicobacter pylori, взаимоотношение которых неясно. Гастрэктомия и длительное подавление кислотной продукции ингибиторами протонной помпы вызывают сходный дефицит секреции внутреннего фактора.
Зоны атрофического гастрита в теле и фундальном отделе могут проявится как метаплазия. Относительный риск развития аденокарциномы желудка у больных аутоиммунным метапластическим атрофическим гастритом повышен в 3 раза.
Диагноз аутоиммунного метапластического атрофического гастрита подтверждается эндоскопической биопсией. Необходимо оценивать уровень сывороточного B12. Можно определить антитела к париетальным клеткам, хотя этот анализ не проводится в рутинных условиях. Вопрос эндоскопического наблюдения для скрининга рака желудка не определен; специальные исследования с целью наблюдения за такими больнымы не нужны, если нет гистологических отклонений (например, дисплазии) или ухудшения морфологической картины и симптомов.
Кроме парентерального замещения витамина B12 лечения не требуется.
ПРИМЕЧАНИЕ:
Это — Профессиональная версия.
ПОЛЬЗОВАТЕЛИ:
Это — Пользовательская версия
© 2019 г. Мерк, Шарп энд Дом Корп., дочерняя компания «Мерк энд Ко. Инкорпорейтед», Кенилворт, Нью-Джерси, США)
Была ли страница полезной?
Источник
Аутоиммунный гастрит: нерешенные вопросы диагностики, значение внутрипросветной эндоскопии
Аутоиммунный гастрит остается недостаточно изученным заболеванием с неустановленной распространенностью и неспецифической клинической картиной. Для аутоиммунного гастрита характерны ассоциация с другими аутоиммунными заболеваниями и повышенный риск развития нейроэндокринных и эпителиальных опухолей желудка. Диагностические критерии аутоиммунного гастрита четко не определены, диагноз основывается на выявлении специфических антител и морфологической верификации, при этом значение внутрипросветной эндоскопии не установлено.
В статье описаны характерные признаки аутоиммунного гастрита, выявляемые при рутинном эндоскопическом исследовании и с применением увеличительной и узкоспектральной визуализации, представлено клиническое наблюдение.
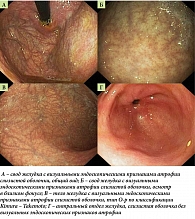
Рис. 1. Эндоскопическое исследование желудка
Таблица 1. Результаты лабораторного обследования

Таблица 2. Результаты морфологического обследования
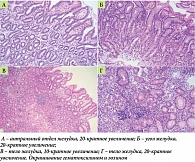
Рис. 2. Гистологическое исследование
По современным представлениям, аутоиммунный гастрит (АИГ) – хроническое иммуноопосредованное заболевание, при котором происходит поражение преимущественно клеток слизистой оболочки тела и дна желудка, характеризующееся развитием двух основных типов аутоантител: антител к париетальным клеткам желудка (АПКЖ) и антител к внутреннему фактору Касла [1]. В 15–20% случаев АИГ приводит к развитию пернициозной анемии, или болезни Аддисона – Бирмера, отличающейся дефицитом витамина B12. Установлена тесная этиопатогенетическая связь между АИГ и другими аутоиммунными заболеваниями [2]. Гипергастринемия, возникающая в результате разрушения париетальных клеток, гипохлоргидрия или ахлоргидрия увеличивают риск эпителиальных и нейроэндокринных опухолей, в связи с чем необходимы своевременная диагностика АИГ и надлежащее последующее наблюдение.
Распространенность АИГ точно не установлена, но считается относительно низкой, что можно объяснить недостаточной и трудоемкой диагностикой и отсутствием клинических проявлений на ранних стадиях. Помимо этого, АИГ во многих случаях протекает под маской Helicobacter pylori-индуцированного атрофического гастрита [3]. Как и другие аутоиммунные заболевания, АИГ чаще встречается у женщин, чем у мужчин: в соотношении 3:1, по данным [2]. Аутоиммунный гастрит обычно диагностируется с использованием комбинации лабораторных и гистологических критериев. Значение эндоскопии изучено недостаточно, но развитие методов оптической и цифровой визуализации может в корне изменить подходы к выявлению и последующему наблюдению пациентов с АИГ.
АИГ и другие аутоиммунные заболевания
Установлено, что АИГ ассоциируется с такими аутоиммунными состояниями, как аутоиммунный тиреоидит, болезнь Аддисона [4], хроническая спонтанная крапивница [5], сахарный диабет 1-го типа [6], миастения, витилиго [7]. В некоторых исследованиях также упоминаются воспалительные заболевания кишечника, системная красная волчанка и аутоиммунная гемолитическая анемия [8].
Впервые связь между АИГ и аутоиммунным заболеванием щитовидной железы была описана в 1960 г. и получила название «тиреогастральный синдром». По мере накопления данных эта связь была охвачена полигландулярным аутоиммунным синдромом типа IIIb (АПС IIIb). Основное заболевание АПС IIIb – аутоиммунный тиреоидит, сочетающийся с одним или несколькими аутоиммунными заболеваниями, не связанными с щитовидной железой. Исключение составляют болезнь Аддисона и гипопаратиреоз, поскольку указанные заболевания идентифицируют полигландулярные аутоиммунные синдромы 1 и 2 соответственно [9, 10].
Полигландулярный аутоиммунный синдром типа IIIb включает аутоиммунные заболевания желудка и кишечника (хронический атрофический гастрит, целиакию, хронические воспалительные заболевания кишечника), а также аутоиммунные заболевания печени (аутоиммунный гепатит, первичный билиарный цирроз). По различным данным, от 10 до 40% пациентов с тиреоидитом Хашимото имеют ассоциированные желудочные расстройства. В исследовании [11] у 320 пациентов с АИГ ассоциированные аутоиммунные заболевания выявлялись в 53,4% случаев, преимущественно в форме аутоиммунного тиреоидита у 116 (36,2%) пациентов.
Встречаемость АИГ увеличивается в три – пять раз у пациентов с сахарным диабетом 1-го типа, достигая 5–10%. В проведенном Диабетологическим центром Вашингтонского университета исследовании проанализировано более 1200 пациентов с сахарным диабетом 1-го типа. Частота и распространенность сопутствующих аутоиммунных расстройств увеличивались с возрастом, а женский пол во многом ассоциировался с сопутствующими аутоиммунными расстройствами [6]. Помимо заболеваний щитовидной железы и коллагенозов АИГ с развитием пернициозной анемии был одним из наиболее частых сопутствующих аутоиммунных заболеваний у пациентов с диабетом 1-го типа [12].
АИГ и H. pylori-ассоциированный атрофический гастрит
В многочисленных исследованиях установлено, что длительное присутствие у пациента H. pylori, как и АИГ, приводит к развитию атрофического пангастрита. Кроме того, у многих пациентов с АИГ выявляется инфекция H. pylori [13]. Также описано развитие H. pylori-позитивного гастрита до АИГ, этиология этого процесса, предположительно, связана с антигенной мимикрией или перекрестной реактивностью [14].
Установлено, что у части пациентов с H. pylori вырабатывается широкий спектр антител, включая антифовеолярные, антиканаликулярные и АПКЖ, характерные для АИГ. Наиболее часто обнаруживаются антиканаликулярные антитела, которые, как и АПКЖ, направлены против H+/K+-АТФазы [15].
Несмотря на схожесть в течении указанных типов гастрита, необходимо дифференцировать АИГ от H. pylori-ассоциированного гастрита. Для АИГ в первую очередь характерно избирательное поражение слизистой оболочки тела и дна желудка, где сосредоточена основная масса париетальных клеток – мишеней аутоантител при АИГ. В то же время поражения, вызванные H. pylori, имеют мультифокальный характер с преимущественным и первичным вовлечением антрального отдела желудка [16].
Дифференцировать АИГ и вызванный H. pylori гастрит возможно по другим отличительным признакам: гипергастринемии, развивающейся в результате гиперплазии энтерохромаффиноподобных клеток; псевдогипертрофии париетальных клеток (редко наблюдается при инфекции H. pylori, но может развиваться при длительном применении препаратов из группы ингибиторов протонной помпы); поражении фундальных желез. Воспалительные изменения в слизистой оболочке желудка характерны для обоих типов гастрита, но имеют ряд отличительных черт. Для АИГ характерна инфильтрация собственной пластинки лимфоцитами и плазматическими клетками с вовлечением глубоких слоев, тогда как для атрофического гастрита, вызванного H. pylori, типичны поверхностные поражения с активным воспалением [17].
Полезным может быть определение таких лабораторных показателей, как гастрин 17 (гипергастринемия характерна для АИГ, редко встречается при H. pylori-ассоциированном гастрите) и уровень пепсиногена I (низкий при АИГ, нормальный – при инфекции H. pylori на стадиях до диффузной атрофии с вовлечением слизистой оболочки тела и дна желудка).
Эндоскопическая характеристика АИГ
До последнего времени роль внутрипросветной эндоскопии в диагностике АИГ ограничивалась в основном получением биопсийного материала для морфологического исследования. Считалось, что в плане диагностики АИГ эндоскопический метод имеет ряд существенных ограничений: низкая чувствительность и специфичность, значительная вариабельность интерпретации визуальных изменений слизистой оболочки между врачами-эндоскопистами, которая определяется квалификацией специалиста и уровнем эндоскопического оборудования [18]. С развитием эндоскопических технологий, появлением аппаратуры с высоким разрешением, увеличительной эндоскопии, узкоспектральной и автофлуоресцентной визуализации стало возможно выявлять минимальные атрофические изменения слизистой оболочки желудка, что существенно повлияло на диагностику АИГ.
В недавно опубликованном многоцентровом японском исследовании [19] в качестве критериев диагностики АИГ помимо наличия специфических антител, пернициозной анемии и гипергастринемии сформулирован такой критерий, как «эндоскопически определяемый атрофический гастрит с преимущественной локализацией в теле желудка». Всем указанным диагностическим признакам соответствовало 245 пациентов из 11 медицинских учреждений Японии. Обследуемые прошли тщательное эндоскопическое исследование. Выполнена фотофиксация, оценка визуальных изменений проводилась тремя эндоскопистами независимо друг от друга, заключения формировались на основании консенсуса. Необходимо отметить, что часть исследований проводилась на оборудовании без функций увеличения и осмотра в узком спектре света, при этом ведущие эндоскопические признаки были четко идентифицированы.
Критерий «эндоскопически определяемый атрофический гастрит с преимущественной локализацией в теле желудка» определен как обесцвеченная, тусклая слизистая оболочка с хорошо визуально различимыми сосудами, наблюдаемая не только на малой кривизне, но и на всей поверхности большой кривизны (открытый тип атрофии O-p по классификации Kimura – Takemoto [20]), в отсутствие или при минимально выраженной атрофии слизистой оболочки в антральном отделе. Кроме указанного критерия, оценивались и другие эндоскопические изменения в слизистой оболочке тела желудка: островки неповрежденной слизистой в своде желудка, свойства слизи, а также рассеянные выступающие мельчайшие белесоватые участки.
При анализе результатов исследования [19] выявлено, что наиболее частым эндоскопическим проявлением АИГ служит наличие атрофических изменений с преимущественной локализацией в теле желудка. Превалировал тип O-p (90%), реже встречались пациенты с типами O-1, O-2, O-3 (суммарно 6%), у 4% обследованных не удалось четко определить распространенность атрофии слизистой оболочки. Другие эндоскопические признаки атрофии выявлялись примерно у трети пациентов. Визуальные изменения слизистой оболочки достоверно коррелировали с морфологической картиной.
Клинический случай
Наши наблюдения соответствуют исследованию [19]. Приведем клинический пример. К гастроэнтерологу на амбулаторном приеме обратилась пациентка 44 лет с жалобами на тяжесть, чувство переполнения в эпигастральной области после еды, чувство раннего насыщения, практически постоянную тошноту, неприятный запах изо рта, а также боли спастического характера в гипогастральной области, метеоризм и кашицеобразный, мажущий стул до трех раз в сутки. Указанные жалобы больная отмечала в течение последних двух лет, ранее не обследовалась и не лечилась, наблюдалась у эндокринолога в связи с первичным гипотиреозом в исходе аутоиммунного тиреоидита, получала терапию левотироксином.
При объективном обследовании: пониженное питание (индекс массы тела по Кетле 16,0 кг/м2), кожные покровы и видимые слизистые умеренно бледные, язык влажный, слегка обложен белым налетом, живот при пальпации мягкий, умеренно болезненный в мезогастральной области и по левому фланку, больше в левой подвздошной области. По другим органам и системам без особенностей.
По результатам осмотра рекомендовано обследование, в том числе эзофагогастродуоденоскопия (ЭГДС) с выполнением уреазного теста на H. pylori. По данным ЭГДС (рис. 1) выявлены эндоскопические признаки атрофии слизистой оболочки желудка с преимущественной локализацией в теле: тусклая, истонченная слизистая с выраженным сосудистым рисунком, типичные складки практически отсутствовали, спрямлены, в просвете вязкая мутная слизь с желчью в небольшом количестве. По классификации Kimura – Takemoto изменения соответствовали открытому типу атрофии О-р. Слизистые оболочки антрального отдела, пищевода и двенадцатиперстной кишки не изменены (рис. 1), уреазный тест на H. pylori отрицательный.
В связи с полученными данными пациентке рекомендовано расширенное обследование: анализы крови на сывороточные пепсиногены I и II, гастрин 17, цианокобаламин, АПКЖ, IgG к H. pylori, а также биопсия слизистой оболочки по Сиднейской системе с последующей морфологической оценкой по OLGA.
По результатам обследования (табл. 1) выявлены характерные для АИГ лабораторные признаки: гипергастринемия, положительные АПКЖ, снижение уровня В12 в сочетании с низкими значениями пепсиногена I и соотношения пепсиногенов I/II.
Результаты морфологического исследования подтвердили и дополнили клинико-лабораторные и эндоскопические данные (табл. 2), отмечена неполная (толстокишечная) метаплазия слизистой оболочки тела желудка (рис. 2). Согласно руководству по лечению предраковых состояний и поражений эпителия желудка (MAPS II), неполный тип кишечной метаплазии ассоциируется с бóльшим риском развития рака желудка (РЖ), чем тонкокишечный (полный) тип, и сопоставим с риском в случаях обширной атрофии слизистой или отягощенного по РЖ семейного анамнеза [21].
Обсуждение результатов
Приведенное клиническое наблюдение наглядно демонстрирует важность эндоскопического исследования для выявления пациентов с АИГ и стратификации риска развития РЖ у данной группы больных. Вместе с тем необходимо отметить, что в рассмотренном примере так же, как и в исследовании [19], представлены случаи с выраженными визуальными изменениями слизистой оболочки. Обнаружение ранних признаков АИГ – приоритетная задача, решение которой, по-видимому, возможно только с применением увеличительной эндоскопии и осмотром слизистой в узком спектре света, а также с учетом пересмотра используемых диагностических критериев.
По наблюдениям T. Kotera и соавт. [22], одним из ранних признаков атрофии при АИГ, выявляемым при эндоскопическом исследовании (до стадии визуально различимой атрофии в теле желудка), могут служить псевдополипоидные красноватые узелки, располагающиеся по большой кривизне, которые при гистологическом исследовании характеризуются очаговой атрофией с сохранением фундальных желез и псевдогипертрофией париетальных клеток.
В работе [23] с помощью увеличительной эндоскопии изучены характерные изменения микрососудистой картины слизистой оболочки желудка при АИГ. Микрососуды слизистой оболочки желудка включают два основных компонента: субэпителиальную капиллярную сеть, вид которой различается в зависимости от отдела желудка (полигональная – в теле, спиралевидная – в антруме), и собирательные венулы (в теле имеют регулярное расположение, в антруме наблюдаются редко). Авторы исследования [23] установили, что при АИГ в антральном отделе желудка микрососуды имели типичную спиралевидную субэпителиальную капиллярную сеть в отличие от микрососудов слизистой оболочки тела желудка, которые характеризовались потерей нормальной полигональной формы с нерегулярно расположенными собирательными венулами. Полученные данные могут быть полезны для дифференциальной диагностики АИГ и H. pylori-ассоциированного атрофического гастрита.
В другом исследовании [24] с применением увеличительной эндоскопии изучались особенности ямочного рисунка слизистой оболочки желудка. Установлено, что визуально различимая атрофия слизистой оболочки тела желудка при АИГ имеет характерный вид – близко расположенные небольшие овальные ямки, отличающиеся от атрофического гастрита, вызванного инфекцией H. pylori.
Визуальные изменения слизистой оболочки желудка при АИГ целесообразно оценивать по совокупности признаков, что существенно повышает чувствительность и специфичность эндоскопического метода.
Заключение
В клинической практике АИГ, заболевания со множеством нерешенных вопросов, сложилась неоднозначная и даже парадоксальная ситуация. С одной стороны, доказано, что АИГ характеризуется повышенным риском нейроэндокринных и эпителиальных опухолей желудка, соответственно необходимы ранняя диагностика, стратификация риска и последующее систематическое наблюдение. С другой стороны, нет четких критериев диагностики данного заболевания, следовательно, у части пациентов АИГ устанавливается на стадии сформированной диффузной атрофии слизистой оболочки, а в некоторых случаях даже ретроспективно, когда выявляется злокачественное новообразование желудка.
Из-за сложностей диагностики АИГ, которая базируется на дорогостоящих лабораторных и морфологических методах, формируется ложное представление о том, что заболевание встречается с невысокой частотой, хотя исследования последних лет свидетельствуют об обратном, особенно в когорте пациентов с другими аутоиммунными заболеваниями.
За последнее десятилетие возможности внутрипросветной эндоскопии значительно выросли. По многим заболеваниям и патологическим состояниям в корне пересмотрены рекомендации по диагностике и наблюдению методами эндоскопии. Созданы классификации и диагностические критерии, позволяющие по визуальным признакам с высоким уровнем достоверности выявлять предраковые изменения слизистой оболочки желудка. По проблеме изучения АИГ также появились публикации, в которых определены типичные изменения слизистой при данном заболевании, в том числе на ранних стадиях.
До 2019 г. не было разработано рекомендаций по эндоскопическому наблюдению за пациентами с АИГ. В 2019 г. в MAPS II [21] были обновлены рекомендации по диагностике и ведению пациентов с кишечной метаплазией и атрофическим гастритом. В систематический обзор литературы вошел также АИГ. Согласно МАРS II, пациентам с АИГ рекомендовано эндоскопическое наблюдение каждые 3–5 лет для оценки эпителиальной дисплазии, карциноидных опухолей и аденокарциномы желудка. Эрадикационная терапия H. pylori показана всем пациентам с неатрофическим хроническим гастритом и АИГ [21].
Источник