Аутоиммунный гастрит сколько живут
Содержание статьи
Аутоиммунный хронический гастрит
Медучреждения, в которые можно обратиться
Общее описание
Аутоиммунный хронический гастрит — это патология, которая ведет к полной атрофии слизистой желудка с развитием недостаточности его секреторной функции. Данный тип гастрита распространен у менее чем одного процента населения, однако каждый шестой хронический гастрит — аутоиммунный. Прогрессирование заболевания, в перспективе, приводит к малокровию, недостаточности витамина В12, полигиповитаминозу, аденокарциноме желудка.
Причиной заболевания является выработка организмом антител против себя, которые повреждают клетки слизистой, ответственные за выработку HCl и, так называемого, внутреннего фактора Касла, участвующего в превращениях витамина В12. Заболевание поражает, преимущественно, фундальный отдел желудка. Следствием этого является атрофия его слизистой, желудочная мальдигестия, анемия с дефицитом витамина В12. Атрофия на начальных этапах болезни очаговая, а затем становится диффузной. Эта стадия уже требуется лечения. Аутоиммунный хронический гастрит зачастую протекает совместно с аутоиммунными заболеваниями щитовидной железы.
Симтпомы аутоиммунного хронического гастрита
-
 давящие боли в эпигастральной области живота сразу после еды;
давящие боли в эпигастральной области живота сразу после еды; - урчание, переливание в желудке;
- снижение аппетита;
- изжога;
- отрыжка тухлым;
- кожа сухая и бледная;
- гиперпигментация кожи;
- заеды в уголках рта;
- кровоточивость десен;
- ломкость волос и ногтей;
- алопеция;
- густой белый налет на языке;
- чередование запоров и поносов;
- похудение;
- гипотония.
Диагностика
Диагноз хронического гастрита вполне возможно поставить и по имеющейся клинической симптоматике, однако, для подтверждения его аутоиммунного характера, необходимо провести следующие исследования:
- ОАК: снижение количества эритроцитов, гемоглобина, тромбоцитов, лейкоцитов, увеличение цифр цветного показателя.
- Биохимия крови: гипербилирубинемия, гипер-γ-глобулинемия.
- Иммунологическое исследование: снижение IgA и IgG, повышение уровня В-лимфоцитов и Т-хелперов более, чем в 6 раз, появление аутоантител к париетальным клеткам и гастромукопротеину.
- Желудочная секреция: снижение кислото- и пепсинообразования, ахлоргидрия.
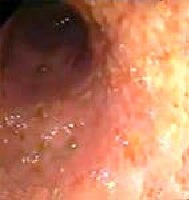
- ФГДС: слизистая желудка атрофична, антральный отдел без патологии.
- Р-скопия желудка: складчатость слизистой не выражена.
- Гистоморфологическое исследование: замещение специализированных желез на псевдопилорические и кишечный эпителий.
Лечение аутоиммунного хронического гастрита
Носит симптоматический характер, направлено на коррекцию желудочного пищеварения и профилактику осложнений. Назначается лечебное питание. Купируется болевой синдром и воспалительные явления в желудке, проводится стимулирование секреции желудка, назначаются заместительные препараты, витамин B12. Проводится коррекция нарушений обмена веществ, инициация процессов репарации, эубиотикотерапия, физиолечение. В период ремиссии — санаторно-курортное лечение. Прогноз для жизни благоприятный.
Основные лекарственные препараты
Имеются противопоказания. Необходима консультация специалиста.



- Вентер (гастропротективное средство). Режим дозирования: при аутоиммунном хроническом гастрите взрослым внутрь по 3 таблетки 2-3 раза в день за 1 ч до еды или через 2 ч после еды. Курс лечения — 30 дней.
- Платифиллин (спазмолитик миотропный, м-холинолитик). Режим дозирования: платифиллин при аутоиммунном хроническом гастрите принимается внутрь, вводится подкожно. Спазмы гладкой мускулатуры (снятие болевого синдрома) — подкожно 0,2% раствора 1-2 мл. Курсовая терапия: внутрь, до еды 2-3 раза в день по 0,003-0,005 г (дети 0,0002-0,003 г) в течение — 15-20 дней. Максимальные дозы: разовая 0,01 г, суточная 0,03 г. Во время терапии платифиллином стоит воздержаться от потенциально опасных видов деятельности, при которых требуется повышенное внимание и быстрота психомоторных реакций.
- Абомин (ферментный препарат). Режим дозирования: при аутоиммунном хроническом гастрите детям старше 14 лет и взрослым назначают внутрь по 1 таб. 3 раза/сут. во время еды в течение 1-2 мес. При недостаточной эффективности разовая доза может быть увеличена до 2-3 таб. на прием, а курс лечения продлен до 3 месяцев.
- Домперидон (Мотилиум, Мотилак, Домперидон) — стимулятор моторики ЖКТ. Режим дозирования: при аутоиммунном хроническом гастрите взрослым назначают по 20 мг (2 таблетки) 3-4 раза/сут. перед едой и перед сном.
Рекомендации
Рекомендуется консультация гастроэнтеролога.
Что нужно пройти при подозрении на заболевание
Общий анализ крови
Для аутоиммунного хронического гастрита характерно снижение количества эритроцитов, гемоглобина, тромбоцитов, лейкоцитов, увеличение цифр цветного показателя.
Биохимический анализ крови
При аутоиммунном хроническом гастрите наблюдаются гипербилирубинемия, гипер-γ-глобулинемия.
Иммунологические исследования
При аутоиммунном хроническом гастрите отмечается снижение IgA и IgG, повышение уровня В-лимфоцитов и Т-хелперов более чем в 6 раз, появление аутоантител к париетальным клеткам и гастромукопротеину.
Фиброэзофагогастродуоденоскопия
При аутоиммунном хроническом гастрите слизистая желудка атрофична, антральный отдел без патологии.
Рентгеноскопия
При аутоиммунном хроническом гастрите складчатость слизистой желудка не выражена.
Гистологическое исследование
При аутоиммунном хроническом гастрите отмечается замещение специализированных желез на псевдопилорические и кишечный эпителий.
Источник
Аутоиммунный гастрит. Симптомы и лечение
Аутоиммунный гастрит связан с нарушением иммунных процессов и встречается редко. Обычно в процесс вовлечены дно и тело желудка, в антральном отделе изменения незначительны. Часто встречается у больных В12-дефицитной анемией.
Причины появления аутоиммунного хронического гастрита до конца не выяснены. Есть мнение, что для развития аутоиммунного гастрита необходимо инициирующее повреждение слизистой оболочки желудка, которое может возникнуть при привычном переедании, употреблении острых или кислых блюд, грубой пищи и при воздействии других причин. После первичного повреждения слизистой запускается наследственно обусловленный механизм аутоиммунных процессов.
Отношения между инфекцией Helicobacter pylori и аутоимунным гастритом остаются неясными. Инфицированность H. pylori среди пациентов с аутоимунным гастритом составляет не более 20%, однако инфекция H. pylori может рассматриваться в качестве триггерного фактора для запуска аутоиммунного воспаления.
При этом заболевании в 9% случаев обнаруживаются антитела к париетальным клеткам и к Н+/К+-АТФазе, в 60% случаев — антитела к фактору Кастла, в 50% случаев — антитиреоидные антитела. Желудочная Н+/К+-АТФаза — органспецифический фермент, главный белок мембран секреторных канальцев париетальных клеток, участвующий в продукции соляной кислоты.
При аутоиммунном гастрите антитела разрушают разрушают железы желудка, содержащие обкладочные клетки, и в результате снижается секреция соляной кислоты. Так как обкладочные клетки секретируют и внутренний фактор Кастла, то нарушается всасывание цианокобаламина (витамина В12), развивается мегалобластная анемия.
При выраженной атрофии фундальных желез клинически наблюдаются гиперплазия G-клеток, гипергастринемия в ответ на ахилию. Установлено, что у больных аутоимунным гастритом риск развития рака желудка в 2,9 раза выше по сравнению со здоровыми лицами того же возраста и пола. Риск развития аутоимунного гастрита повышается с возрастом, заболевание часто сочетается с другими аутоиммунными заболеваниями.
Симптомы аутоимунного гастрита
Жалобы больных обычно малоспецифичны. Пациенты жалуются на тяжесть в желудке, переполнение желудка после приема пищи. Боли в области желудка встречаются значительно реже. Часто просто отмечается определённый дискомфорт в верху живота. После еды возникает отрыжка воздухом, с течением времени у отрыжки появляется горький или тухлый привкус. Изжога.
Снижение аппетита при выраженной атрофии слизистой оболочки и снижении секреторной функции желудка, возможно значительное похудание.
Со стороны кишечника — урчание, нестабильная дефекация (запоры сменяются поносами). После еды возможны слабость, потливость, головокружение.
С течением времени из-за нарушения всасывания в желудке и кишечнике питательных веществ и витаминов может развиться гиповитаминоз А и С. Появляется сухость кожи, ухудшение зрения из-за дефицита витамина А, побледнение, вследствие анемии. Недостаток витамина С может обусловить возникновение кровоточивости десен. Усиливается выпадение волос, ногти становятся ломкими. Дефицит витамина В2 приводит к появлению «заед» в углах рта.
В большинстве случаес типичность симптомов не позволяет определить диагноз посредством первичной клинической диагностики. Диагностику существенно затрудняет отсутствие выраженных клинических симптомов, которые могут маскироваться проявлениями других аутоиммунных заболеваний, часто сочетающихся с аутоимунным гастритом. Диагноз аутоиммуного гастрита устанавливают при помощи рентгеноскопии желудка, гастроскопического и гистологического исследований. Проводится исследование функционального состояния желудка — зондирование желудка, внутрижелудочная pH-метрия. Назначается иммунологическое обследование крови.
Аутоиммунный гастрит в фундальном отделе при тяжелом поражении слизистой оболочки желудка и у больных в возрасте старше 50 лет приобретает наклонность к быстрому прогрессированию. В антральном отделе, напротив, наблюдается стабилизация и даже возможно обратное развитие воспалительного процесса с исчезновением круглоклеточной воспалительной инфильтрации. Исследования указывают, что в теле желудка при аутоиммунном гастрите с течением времени воспалительная инфильтрация также уменьшается и доминирующее значение начинает приобретать атрофия слизистой оболочки желудка.
Лечение аутоимунного гастрита аналогично лечению хронического гастрита. К сожалению, лечение помогают смягчить воспалительный процесс, но не воздействуют на саму причину. Принципы работы иммунной системы до сих пор изучены недостаточно.
Источник
Атрофический гастрит: прогнозы и перспективы — Eurolab
О.Я. Бабак,
д.м.н., профессор, директор Института терапии им. Л.Т. Малой АМН Украины, г. Харьков
Под атрофическим гастритом понимают прогрессирующий воспалительный процесс слизистой оболочки желудка, характеризующийся утратой желудочных желез. Клинико-морфологической особенностью атрофического гастрита являются уменьшение числа специализированных гландулоцитов, обеспечивающих секреторную функцию желудка, и замещение их клетками более простыми, в том числе вырабатывающими слизь. Обширная атрофия слизистой оболочки тела желудка, как правило, ассоциируется с гипосекрецией соляной кислоты и нарушением выработки пепсиногена.
Что сегодня известно об атрофическом гастрите?
Наиболее частыми этиологическими факторами, вызывающими атрофический гастрит, признаны инфекция Helicobacter Pylori (Н.Pylori) и аутоиммунный гастрит. Причем, с Н. pylori связывают возникновение подавляющего большинства атрофических гастритов. Бактерии Н. рylori, персистируя на желудочном эпителии, вызывают хронический хеликобактерный поверхностный гастрит. Длительно существующий поверхностный хеликобактерный гастрит без соответствующего лечения трансформируется в атрофический.
Атрофический гастрит клинически, как правило, в течение длительного времени ничем себя не проявляет, поэтому диагноз хронического гастрита, скорее, морфологический, нежели клинический. Основным методом диагностики атрофического гастрита является эндоскопическое исследование. При эндоскопии производят осмотр пищевода, желудка, двенадцатиперстной кишки. При выраженной атрофии слизистая оболочка желудка имеет характерные отличия в сравнении с таковой при, например, поверхностном гастрите.
Окончательный диагноз позволяет установить морфологический анализ биоптатов слизистой оболочки желудка, взятых во время эндоскопии. Морфологически атрофия определяется уменьшением числа функционирующих специализированных клеток желудка. Доказано, что при Н. pylori-ассоциированном гастрите процессы атрофии чаще возникают при инфицировании определенными штаммами (Cag A+ и Vac A+) Н. pylori. Одним из морфологических признаков атрофического гастрита является кишечная метаплазия, которая традиционно рассматривалась как предраковое изменение слизистой оболочки желудка.
Другие методы исследования — рентгенография желудка, ультразвуковое исследование брюшной полости и компьютерная томография — в плане диагностики атрофического гастрита неинформативны.
Чего нужно опасаться при атрофическом гастрите? Каков прогноз болезни?
Гипотетически наличие атрофического гастрита при естественном течении может иметь два сценария. Первый — длительно существующий хронический гастрит приводит к значительному уменьшению кислотообразующей функции желудка, требующему заместительной терапии, без которой будут наблюдаться признаки нарушения пищеварительной функции. Второй вариант — в результате длительного хронического персистирующего воспаления в слизистой оболочке желудка, характерного для Н. pylori-ассоциированного гастрита, происходит нарушение клеточного обновления в желудке, что способствует появлению клеток-мишеней для влияния на них канцерогенных веществ, в дальнейшем — к клеточным мутациям. В результате нормальный клеточный эпителий желудка замещается метапластическим, диспластическим и неопластическим.
По определению ВОЗ, под дисплазией понимают такие клеточные изменения, при которых часть эпителия замещена клетками с различной степенью атипии. В международной классификации эпителиальных неоплазий пищеварительного тракта (2000) дисплазия — это неоплазия, другими словами — опухоль. Итак, атрофический гастрит может трансформироваться в рак желудка. Наибольшую опасность в плане развития рака представляет атрофический гастрит с пониженной кислотообразующей функцией желудка (частота возникновения рака — до 13%). Среди известных в настоящее время молекулярных механизмов, лежащих в основе наследственной предрасположенности к раку желудка, выделены: индукция экспрессии TGF-β1, частичный полиморфизм кластера гена IL-1 (IL-1β). В результате развития атрофии слизистой оболочки желудка снижается ее противоопухолевая защита, создаются условия для активного воздействия канцерогенов. При возникновении тяжелой атрофии эпителия тела желудка риск развития рака желудка повышается в 5 раз в сравнении с таковым при неатрофическом гастрите.
Бактерии Н. pylori относят к биологическим канцерогенам в отношении рака желудка. Большинство исследователей считают, что Н. pylori — это основной этиологический фактор развития хронического гастрита, который является обязательным звеном в каскаде процессов, приводящих к раку желудка. На основании анализа результатов многоцентровых исследований Международное агенство по изучению рака при ВОЗ еще в 1994 году рекомендовало считать инфекцию Н. pylori абсолютным канцерогеном для человека.
В настоящее время рак желудка рассматривается как конечный результат длительного многоступенчатого и многофакторного процесса, в котором клеточные изменения слизистой оболочки желудка обусловлены нарушениями микроокружения. Этот процесс называют именем описавшего его автора — каскадом Корреа (1995). Он включает хронический гастрит, кишечную метаплазию, дисплазию и рак. Н. рylori-ассоциированный желудочный канцерогенез — многоэтапный процесс, характеризующийся развитием хронического гастрита — первой ступени в эволюционном каскаде. Последующие изменения приводят к формированию атрофии, тонкокишечной (I и II типы) и толстокишечной (III тип) метаплазий и дисплазии желудочного эпителия, в итоге — к аденокарциноме желудка. Именно атрофический гастрит занимает срединное положение в цепи вышеперечисленных изменений на пути к раку желудка.
Как избежать трансформации атрофического гастрита в рак желудка?
Ответ на данный вопрос состоит из равных по значимости частей: как можно раннее выявление предраковых изменений, их адекватное лечение и предупреждение (профилактика) проявления последних. При наблюдении больных хроническим гастритом важно уловить тот момент, когда возникает и начинает прогрессировать атрофия слизистой оболочки желудка, причем желательно это проводить простым информативным и неинвазивным способом.
Своевременное выявление атрофии слизистой оболочки желудка — первый диагностический этап выявления риска по раку желудка.
Многочисленные исследования последних лет показали, что очаги полной и неполной кишечной метаплазии слизистой оболочки желудка нельзя расценивать в качестве достоверного маркера повышенного риска развития рака желудка. Исследования свидетельствуют, что значительно важнее оценка не типа метаплазии, а ее объема. Так, при большом объеме метаплазии, превышающем 20% поверхности желудочного эпителия, создаются реальные условия для развития дисплазии с последующим образованием аденокарциномы желудка. Следовательно, риск развития рака желудка повышается при тяжелой атрофии желудочного эпителия, характеризующейся обширными очагами кишечной метаплазии.
Как же на практике определить площадь такого поражения? Следует помнить, что данные изменения происходят на клеточном уровне, и при обычной эндоскопии их распознать невозможно. Доступным и эффективным способом диагностики метапластических изменений в слизистой оболочке желудка является метод хромогастроскопии — прижизненная окраска слизистой желудка красителем (чаще метиленовым синим), проводимая во время эндоскопического исследования. Данная методика основана на поглощении красителя очагами кишечной метаплазии, что позволяет оценить их размеры, выполнить прицельную биопсию для гистологического анализа биоптата слизистой и выявить возможную дисплазию или метаплазию.
Вместе с тем морфологическая диагностика атрофического гастрита сопряжена с рядом трудностей. Сложность постановки диагноза атрофии морфологическим методом обусловлена тем, что на ранних стадиях процесс никогда не бывает диффузным, следовательно, результаты гастробиопсии могут способствовать гипер- и гиподиагностике. При воспалении может изменяться микроскопическая картина и неадекватно оцениваться проявления атрофического гастрита из-за ложного вывода о потере желез. Высока и субъективность методики. Все это заставляет искать другие надежные пути тестирования атрофических изменений слизистой оболочки желудка.
Разработан ряд малоинвазивных гематологических тестов (тестовая панель Biohit), позволяющих избежать ошибок диагностики, дать совокупную оценку состояния слизистой оболочки желудка, степени ее атрофии и потери нормальных желез и клеток в антральном отделе и теле желудка.
Во время проведения эндоскопического исследования обязательно должна проводиться детекция на наличие Н. pylori. При этом наиболее целесообразным следует признать уреазный или гистологический методы (из гастробиоптатов) исследования.
Определение уровня сывороточного пепсиногена (S-PGІ) или соотношения содержания пепсиногена I к пепсиногену II (PGI/PGII) — неэндоскопический метод диагностики атрофического гастрита с поражением тела желудка. С увеличением степени атрофии слизистой оболочки тела желудка (потеря нормальных кислотообразующих желез) уровни S-PGI и PGI/PGII постепенно снижаются. Определение уровня гастрина в сыворотке крови, преимущественно гастрина-17 (S-G-17), может быть использовано в качестве индикатора морфологического состояния слизистой оболочки антрального отдела желудка. То есть снижение S-G-17 является биохимическим маркером атрофического гастрита с поражением антрального отдела желудка (потеря антральных G-клеток).
Снижение уровней S-G-17 и S-PGI можно рассматривать как результат прогрессирующего атрофического гастрита с потерей нормальных желез и клеток слизитой оболочки тела и антрального отдела желудка. G-17 практически полностью синтезируются и секретируются G-клетками антрального отдела желудка. Эти клетки являются компонентами нормальных антральных желез, в случае прогрессирования атрофического гастрита их количество уменьшается на фоне поражения антральных желез и появления кишечной метаплазии. При Н. pylori-ассоциированном гастрите имеется тенденция к возрастанию серологических уровней G-17 и PGI. Низкая внутрижелудочная кислотность способствует увеличению серологического уровня G-17, и наоборот.
Перманентная длительная гипо- или ахлоргидрия приводят к чрезвычайно высоким уровням G-17 в крови. Особенно часто это наблюдается при пониженной кислотности (атрофический гастрит с поражением тела желудка) в сочетании с сохраненной слизистой оболочкой антрального отдела. Такая клиническая картина наиболее характерна для аутоиммунного атрофического гастрита. Если в антральном отделе имеются сопутствующие признаки атрофии слизистой оболочки (мультифокальный атрофический гастрит), тогда содержание S-G-17 не возрастает, и тестовая панель показывает низкие значения уровней S-PGI и S-G-17.
Совокупная точность тестовой панели в диагностике атрофического гастрита — около 80% (при сопоставлении с результатами эндоскопии и биопсии). Данная тестовая панель является малоинвазивной альтернативой первоначального обследования пациентов с подозрением на желудочную атрофию и дисплазию. Она позволяет надежно выявлять пациентов с различными формами гастрита, определять локализацию и этиологию патологического процесса, оценивать вероятность развития рака желудка и выстраивать дальнейшую тактику ведения больного.
Учитывая связь возникновения атрофии желудочного эпителия и кишечной метаплазии с инфекцией Н. pylori, становится очевидным выбор метода лечения и профилактики дальнейшего прогрессирования процесса. Методом выбора является антихеликобактерная терапия.
В 2002 году японские исследователи убедительно доказали возможность регрессии метапластических изменений слизистой оболочки желудка после успешного уничтожения бактерий Н. pylori. С помощью хромоскопии им удалось установить, что в течение пяти лет после проведения успешной антихеликобактерной терапии размеры очагов кишечной метаплазии уменьшились почти в 2 раза в сравнении с исходными. В последующих исследованиях подтвердилась целесообразность такого терапевтического подхода.
В настоящее время не вызывает сомнений необходимость проведения антихеликобактерной терапии пациентам с атрофическим гастритом. Предварительные данные нескольких многоцентровых исследований по мониторингу Н. pylori-ассоциированного предрака и рака желудка свидетельствуют в пользу реверсии воспаления слизистой оболочки желудка и связанных с ней атрофии, кишечной метаплазии и генетической нестабильности. В связи с этим в идеале пациентам с Н. pylori-позитивным хроническим атрофическим гастритом необходимо проводить эрадикационную терапию, а при отсутствии эффекта — исследование с целью выявления маркеров генетической нестабильности и тщательный мониторинг.
Данная рекомендация нашла отражение в международных рекомендациях по диагностике и лечению заболеваний, ассоциированных с Н. pylori — Маастрихтском консенсусе 3 (2005). Для уничтожения бактерий Н. pylori, как и в Маастрихтском консенсусе 2 (2000), рекомендованы трех- и четырехкомпонентные схемы антибактериальных препаратов в сочетании с ингибиторами протонной помпы (ИПП) в стандартных дозах: ИПП + кларитромицин + амоксициллин и ИПП + тетрациклин + метронидазол (фуразолидон) + коллоидный висмут.
Вместе с тем следует помнить, что полное восстановление структуры слизистой оболочки при тяжелой атрофии до нормы требует длительного времени, и в ряде случаев, по всей видимости, это не возможно. В случаях, когда предопухолевые процессы не подвергаются обратному развитию либо прогрессируют, необходимо применять более радикальные методы лечения, используя арсенал современных эндоскопических операций, вплоть до резекции слизистой оболочки желудка.
Главная цель первичной профилактики атрофического гастрита — своевременное и эффективное лечение поверхностного хеликобактерного гастрита. Для этого используют стандартные схемы антихеликобактерной терапии, в соответствии с рекомендациями Маастрихтских консенсусов 2 (2000) и 3 (2005). Важным моментом является последующий контроль за успешностью этой терапии. Контроль необходимо проводить с использованием неинвазивных методов (дыхательного уреазного или стул-теста). При неудачной эрадикации проводить повторные курсы лечения.
Кроме того, доказано, что, придерживаясь здорового режима питания, можно снизить онкологический риск (прогрессирование атрофии), что подтверждено в исследованиях, проведенных в ряде стран. Рекомендуется избегать употребления консервированных, маринованных и копченых продуктов, отказаться от курения и употребления крепких спиртных напитков (особенно в сочетании с жирной, жареной, копченой и соленой пищей), исключить переедание. Необходимо контролировать массу тела, выполнять активные физические нагрузки, употреблять больше свежих овощей (в том числе лук и чеснок), фруктов и натуральных соков, витаминов А, С, b-каротина, зелени, круп грубого помола, молочных продуктов. В некоторых развитых странах Европы и США внедрение здорового образа жизни привело к снижению заболеваемости раком желудка в несколько раз, сегодня это заболевание в этих странах считается редким, составляя лишь 3% среди злокачественных новообразований. Мониторирование — постоянное наблюдение с периодическим повторным обследованием — абсолютно обязательно для пациентов с атрофическим гастритом
Итак, в настоящее время очевидна необходимость особого внимания к атрофическому гастриту. Комплексное применение современных методов исследования — эндоскопического, морфологического, гематологического (тестовой панели) и других — способствует его точной диагностике. Использование эффективных методов лечения и профилактики атрофического гастрита, устранение условий, которые способствуют его развитию, представляют сегодня реальную возможность улучшить прогноз этого заболевания, устранить риск развития рака желудка.
Литература
1. Е.Г. Бурдина, Е.М. Майорова, Е.В. Григорьева, И.И.Тимофеева, О.Н. Минушкин // Гастрин-17 и пепсиноген І в оценке состояния слизистой оболочки желудка // Российский медицинский журнал, 2006, №2, с. 9-11.
2. Х. Ваананен, М. Ваухконен, Т. Хэлске, И. Каариянен, М. Расмуссен, Х. Тунтури-Хихнала, Дж. Коскенпато, М. Сотка, М. Турунен, Р. Сандстрем, М.Ристиканкаре, А. Юссила, П. Сиппонен // Неэндоскопическая диагностика атрофического гастрита на основании анализа крови: корреляция между результатами гистологического исследования желудка и уровнями гастрина-17 и пепсиногена І в сыворотке // Клинические перспективы гастроэнтерологии, гепатологии, 2003, № 4, с. 26-32.
3. В.Д. Пасечников, С.З. Чуков, С.М. Котелевец / Профилактика рака желудка на основе эрадикационной терапии предопухолевых заболеваний // Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 2003, № 4, с. 11-19.
4. А.А. Шептулин, В.А. Киприанис / Диагностика и лечение инфекции Helicobacter pylori: основные положения согласительного совещания «Маастрихт — 3» // Российский журнал гастроэнтерологии гепатологии колопроктологии, 2006, № 2, с. 88-91.
5. Kim N., Lim S. H., Lee K.H. et al. Long-term effects of Helicobacter pylori eradication on intestinal plasia in patients with duodenal and behign gastric ulcers Dig. Dis. Sci. — 2000. — Vol. 45. — 1754-1762.
6. Malfertheiner P., Megraud F., O’Morain C. еt al. Current concepts in the management of Helicobacter pylori infection — The Maastricht 2 Concensus Report // Aliment. Pharmacol. Ther. — 2002. — Vol. 16. — P. 167-180.
Источник