Атрофический гастрит при целиакии
Содержание статьи
Целиакия (Глютеновая энтеропатия)
Целиакия — это генетически обусловленное нарушение функции тонкого кишечника, связанное с дефицитом ферментов, расщепляющих пептид глютен. При целиакии развивается синдром мальабсорбции различной степени выраженности, сопровождающийся пенистой диареей, метеоризмом, похуданием, сухостью кожи, задержкой физического развития детей. Для выявления целиакии применяются иммунологические методы (определение Ат к глиадину, эндомизию, тканевой трансглутаминазе), биопсия тонкой кишки. При подтверждении диагноза требуется пожизненное соблюдения безглютеновой диеты, проведение коррекции дефицита необходимых веществ.
Общие сведения
Целиакия (глютеновая энтеропатия) — заболевание, характеризующееся хроническим воспалением слизистой тонкого кишечника, сопровождающимся нарушением всасывания и возникающим в результате непереносимости глютена (белка, который содержится в хлебных злаках: пшеницы, ржи и ячмене). В состав белка глютена входит L-глиадин — вещество, оказывающее токсическое действие на слизистую и ведущее к нарушению абсорбции питательных веществ в кишечнике.
Заболевание более характерно для женщин, они страдают целиакией в два раза чаще мужчин. Чаще всего (в 85% случаев) полное исключение глютена из рациона вызывает восстановление функциональности тонкого кишечника через 3-6 месяцев.
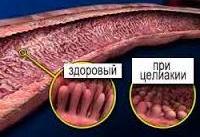
Целиакия
Причины целиакии
Целиакия имеет генетическую предрасположенность. Это подтверждается выявлением нарушений со стороны тонкокишечной стенки у 10-15 % членов семей (родственников первой степени) пациентов, страдающих этим заболеванием.
Также отмечена зависимость заболеваемости от иммунного статуса. В организме больных целиакией отмечают повышение титров антител к L-глиадину, тканевой трансглутаминазе и эндомиозину (белку, содержащемуся в гладкомышечных волокнах). Подтверждают иммунную зависимость заболевания и нередко сопутствующие патологии, имеющие аутоиммунный характер:
- сахарный диабет I типа;
- заболевания соединительной ткани;
- ювенильный ревматоидный артрит;
- аутоиммунный тиреоидит;
- герпетиформный дерматит;
- синдром Шегрена.
Патогенез
Некоторые врожденные или приобретенные особенности работы тонкого кишечника способствуют возникновению повышенной чувствительности клеток кишечного эпителия к глиадину. К таким состояниям относится ферментная недостаточность, в результате которой плохо расщепляются пептиды (и не происходит полного расщепления глиадина). Накопление глиадина в кишечнике способствует проявлению его токсического действия.
Аутоиммунные нарушения в тех случаях, когда мишенью для собственных антител становятся эпителиальные клетки кишечника, способствуют снижению их защитных свойств и повышению чувствительности к глиадину. Помимо этого, факторами, способствующими возникновению непереносимости глиадина, являются генетически обусловленные специфические характеристики рецепторов клеточной мембраны кишечного эпителия, а также результат изменения рецепторного аппарата некоторыми вирусами. При целиакии отмечаются характерные атрофические изменения ворсинок слизистой оболочки тонкого кишечника.
Классификация
В клинической гастроэнтерологии различают три формы течения целиакии:
- типичная (развивается на первом-втором году жизни, имеет характерные клинические проявления);
- стертая (проявляется внекишечной симптоматикой: железодефицит, анемия, кровоточивость, остеопороз);
- латентная (без выраженных жалоб), часто встречается у лиц пожилого возраста.
Симптомы целиакии
Клинические признаки целиакии — это диарея, стеаторея, похудание, полигиповитаминозы и прочие проявления синдрома мальабсорбции. У женщин развитие клинических симптомов начинается в 30-40 лет, у мужчин в 40-50.
Целиакия у детей начинает проявляться обычно в 9-18 месяцев. Появляется частый и жидкий стул с большим количеством жира и отмечается снижение массы тела, отставание в росте. У взрослых развертывание клинических симптомов целиакии может быть спровоцировано беременностью, перенесенными оперативными вмешательствами, инфекцией. Лица, страдающие целиакией, зачастую отмечают склонность к сонливости, сниженной работоспособности, часто урчание в животе, метеоризм, неустойчивость стула (поносы, сменяющиеся запорами). У пожилых пациентов могут отмечаться боли и ломота в костях, мышцах.
Стул, как правило, частый (5 и более раз в день), жидкий, пенистый с остатками непереваренной пищи. При продолжительной диарее есть вероятность развития признаков обезвоживания: сухость кожных покровов и слизистых оболочек. Прогрессирование синдрома мальабсорбции ведет к развитию тяжелых расстройств внутреннего гомеостаза организма.
Осложнения
Больные целиакией относятся к группе повышенного риска возникновения рака кишечника (кишечной лимфомы, аденокарциномы). Этот вид злокачественной опухоли развивается у 6-8% больных, чаще всего после 50 лет. Возникновение злокачественного новообразования подозревают в том случае, если клинические проявления целиакии возобновились на фоне безглютеновой диеты.
Еще одним вероятным осложнением целиакии является язвенный еюноилеит (воспаление со склонностью к изъязвлению стенки тощей и подвздошной кишок). Характеризуется развитием острой болезненности в животе, лихорадкой. Развитие этого состояния грозит внутренним кровотечением, прободением стенки тонкого кишечника, перитонитом. При выраженной недостаточности всасывания железа развивается железодефицитная анемия. Иногда она становится единственным проявлением заболевания (при стертой и латентной форме).
Нарушения фертильности, бесплодие могут быть результатом длительно существующего синдрома мальабсорбции. Также продолжительное нарушение всасывания ведет к полигиповитаминзам, белковой недостаточности, нарушениям минерального обмена. Недостаток витамина D в сочетании с пониженным поступлением кальция в организм способствует снижению плотности костей, их ломкости. В 30-35% случаев у больных целиакией уменьшается в размерах селезенка, 70% пациентов отмечают артериальную гипотензию.
Диагностика
Диагностика целиакии проводится врачом-гастроэнтерологом. Используется комплекс функциональных, лабораторных, инструментальных (лучевых и эндоскопических методов):
- Определение специфических антител. Наиболее специфичной методикой выявления целиакии является определение в крови антител к глиадину и антител к тканевой трансглутаминазе. Чувствительность методики составляет 100%, ее специфичность для данной патологии порядка 95-97%.
- Эндоскопическая биопсия. Производится эндоскопическое исследование тонкого кишечника, биопсия слизистой для определения имеющейся атрофии (сглаживания) ворсин, а также наличия скоплений лимфоцитов в слизистой.
- Инструментальные методы. Дополнительными методиками для уточнения состояния больного являются УЗИ органов брюшной полости, компьютерная томография, МРТ-ангиография мезентериальных сосудов, контрастная рентгеноскопия кишечника.
- Функциональные тесты. С целью оценки всасывательной способности тонкого кишечника выполняются тест Шиллинга и проба с D-ксилозой.
Лечение целиакии
 Цель терапии при целиакии — восстановление функций кишечника, нормализация массы тела и коррекция дефицита необходимых веществ.
Цель терапии при целиакии — восстановление функций кишечника, нормализация массы тела и коррекция дефицита необходимых веществ.
Безглютеновая диета
Патогенетическое лечение заключается в соблюдении аглютеновой диеты, то есть непосредственное избегание действия повреждающего фактора. Соблюдать безглютеновую диету необходимо на протяжении всей жизни. Чаще всего (в 85% случаев) эта мера приводит к стиханию симптомов и восстановлению нормальной деятельности кишечника.
Глютен содержится в следующих продуктах: хлеб и любые изделия из пшеничной, овсяной, ячменной и ржаной муки, макаронные изделия, манная крупа. В небольших концентрациях глютен может обнаруживаться в колбасах и сосисках, мясных и рыбных консервах, шоколаде, мороженом, майонезе и кетчупе, различных соусах, растворимом кофе и порошке какао, продуктах из сои, супах быстрого приготовления, бульонных кубиках, продуктах, содержащих солодовый экстракт. Из напитков необходимо отказаться от пива, кваса, водки.
Зачастую больным целиакией следует ограничить употребление цельного молока, поскольку у них может отмечаться непереносимость лактозы (молочного сахара). В настоящее время в продаже имеются специальные диетические безглютеновые продукты (маркированы перечеркнутым колосом).
Как правило, окончательное восстановление происходит не ранее чем через 3-6 месяцев, поэтому корректировать содержание необходимых организму веществ требуется на протяжении всего времени выздоровления. При необходимости назначают парентеральное питание, введение препаратов железа и фолиевой кислоты, солевые растворы, кальций, витамины.
Медикаментозная терапия
Тем пациентам, которые не обнаруживают положительного эффекта диеты, назначаются гормональные препараты (преднизолон) на протяжении 6-8 недель в качестве противовоспалительной терапии.
Отсутствие положительной динамики при исключении глютена из рациона в течение трех месяцев может говорить о том, что диета соблюдается не полностью, с нарушениями, либо имеются сопутствующие заболевания (недостаточность дисахаридазы, болезнь Аддисона, лимфома тонкого кишечника, язвенный еюнит, лямблиоз, недостаток минералов в рационе: железа, кальция, магния).
В таких случаях проводятся дополнительные диагностические мероприятия для выявления этих состояний. При исключении всех возможных причин отсутствия улучшений назначают гормональную терапию. Через три месяца курса преднизолона проводят биопсию тонкого кишечника.
Прогноз
Корректировать чувствительность клеток эпителия к глютену в настоящее время не представляется возможным, поэтому больные целиакией должны соблюдать безглютеновую диету на протяжении всей жизни. Тщательное ее соблюдение ведет к сохранению качества и продолжительности жизни. При несоблюдении диеты выживаемость резко падает, случаи летального исхода среди больных целиакией, нарушающих безглютеновую диету, составляют 10-30%, в то время как при строгом следовании диете этот показатель не превышает одного процента.
Все лица, страдающие целиакией, должны находиться на диспансерном учете у гастроэнтеролога и ежегодно проходить обследование. Для больных, которые слабо реагируют на исключение глютена из рациона, диспансерное наблюдение показано дважды в год. Прогноз заметно ухудшается, если это заболевание осложняется возникновением лимфомы тонкого кишечника.
Профилактика
Первичной специфической профилактики целиакии не существует. Вторичная профилактика развития клинических симптомов заключается в соблюдении безглютеновой диеты. При имеющейся у ближайших родственников целиакии желательно проводить периодическое обследование на предмет выявления специфических антител. Беременные женщины, страдающие целиакией, попадают в группу риска по развитию пороков сердца у плода. Ведение беременности у таких женщин должно осуществляться с повышенным вниманием.
Источник
Прогностические факторы и значение неполного восстановления слизистой оболочки при целиакии после 1 года безглютеновой диеты
Целиакия — это глютен-индуцированная энтеропатия, имеющая клиническое значение в течение всей жизни пациента, с распространенностью до 2% в кавказских популяциях. На сегодняшний день эффективным лечением является только пожизненное соблюдение безглютеновой диеты, при чем строгая диета четко коррелирует с облегчением симптоматики. Для постановки диагноза необходимо подтверждение глютен-индуцированного повреждения слизистой оболочки тонкой кишки и гиперплазии крипт при биопсии ее. Современные рекомендации несколько противоречивы относительно того, следует ли повторять биопсию после 1 года диетического лечения. Основными причинами рутинной последующей биопсии является мониторинг гистологического восстановления и соблюдения диеты, а также исключение серьезных осложнений, таких как рефрактерная целиакия у пациентов, не поддающихся лечению. Только у 0,3% развивается рефрактерная целиакия.
Тем не менее, значительная часть пациентов с целиакией не достигает полного восстановления слизистой оболочки через 1 год, тогда как в долгосрочной перспективе это наблюдается у 96% пациентов. Персистирующая атрофия ворсинок предрасполагает к тяжелым осложнениям и увеличению смертности в долгосрочной перспективе. В настоящее время неясно, существуют ли специфические факторы, связанные с пациентом и скоростью восстановления ворсинок, преобладает ли корреляция между клиническими исходами и восстановлением слизистой оболочки после 1 года лечения, и имеет ли неполное восстановление слизистой через 1 год на безглютеновой диете длительный эффект.
Наиболее выраженным фактором, предсказывающим неполное восстановление слизистой тонкой кишки, было наличие при диагностике более тяжелого заболевания с точки зрения гистологии и серологии и признаков мальабсорбции. Тем не менее, в то время как восстановление слизистой оболочки еще продолжалось, большинство клинических параметров улучшались. Результаты исследования свидетельствуют о том, что последующая биопсия через 1 год плохо коррелирует с клиническим исходом и долгосрочным прогнозом и представляет собой лишь «моментальный снимок», а не конечную точку продолжающегося заживления слизистой оболочки.
В общей сложности 68% испытуемых продемонстрировали морфологическое восстановление слизистой оболочки после 1 года диеты. Все пациенты превосходно придерживались диеты.
Обнаружена связь между тяжестью исходного повреждения, в частности, атрофии и медленным гистологическим восстановлением.
Еще одним показателем наличия более тяжелого заболевания в группе атрофии при постановке диагноза был их более высокий уровень TG2ab, даже если эти антитела являются плохими предикторами тяжести гистологических и клинических показателей у отдельных больных. TG2ab также оставался на более высоком уровне у не полностью выздоровевших пациентов через 1 год. Кроме того, большинство пациентов с атрофией стали серонегативными, что указывает на то, что исчезновение антител происходит быстрее, чем заживление слизистой оболочки.
Из клинических проявлений наличие мальабсорбции было связано с отсутствием гистологического восстановления слизистой. Это было наиболее очевидно при низких уровнях железа, а также гемоглобина в группе атрофии, что отражает недостаточное поглощение питательных веществ у пациентов с тяжелой атрофией ворсин.
Слабая корреляция между гистологическим восстановлением и другими результатами анализов указывает на то, что последующая биопсия, проведенная через 1 год, не является оптимальным подходом в мониторинге целиакии.
Таким образом, только наличие более тяжелого заболевания с точки зрения гистологии и серологии было связано с неполным гистологическим восстановлением при последующей биопсии. Более того, различия в скорости заживления слизистой оболочки не отражались на краткосрочных или отдаленных клинических исходах. На основе этих результатов следует применять более персонализированный подход при определении оптимальных сроков гистологического наблюдения. Один год часто является слишком коротким для восстановления слизистой оболочки, и отсрочка биопсии, например, еще на один год, вероятно, приведет к меньшему числу случаев с продолжающейся атрофией.
Henna Pekki, BM; Kalle Kurppa, MD, PhD; Markku Mäki et al. Predictors and ificance of Incomplete Mucosal Recovery in Celiac Disease After 1 Year on a Gluten-free Diet. Am J Gastroenterol. 2015;110(7):1078-1085.
https://www.medscape.com/viewarticle/848402_4
©
Источник
Атрофический гастрит: прогнозы и перспективы — Eurolab
О.Я. Бабак,
д.м.н., профессор, директор Института терапии им. Л.Т. Малой АМН Украины, г. Харьков
Под атрофическим гастритом понимают прогрессирующий воспалительный процесс слизистой оболочки желудка, характеризующийся утратой желудочных желез. Клинико-морфологической особенностью атрофического гастрита являются уменьшение числа специализированных гландулоцитов, обеспечивающих секреторную функцию желудка, и замещение их клетками более простыми, в том числе вырабатывающими слизь. Обширная атрофия слизистой оболочки тела желудка, как правило, ассоциируется с гипосекрецией соляной кислоты и нарушением выработки пепсиногена.
Что сегодня известно об атрофическом гастрите?
Наиболее частыми этиологическими факторами, вызывающими атрофический гастрит, признаны инфекция Helicobacter Pylori (Н.Pylori) и аутоиммунный гастрит. Причем, с Н. pylori связывают возникновение подавляющего большинства атрофических гастритов. Бактерии Н. рylori, персистируя на желудочном эпителии, вызывают хронический хеликобактерный поверхностный гастрит. Длительно существующий поверхностный хеликобактерный гастрит без соответствующего лечения трансформируется в атрофический.
Атрофический гастрит клинически, как правило, в течение длительного времени ничем себя не проявляет, поэтому диагноз хронического гастрита, скорее, морфологический, нежели клинический. Основным методом диагностики атрофического гастрита является эндоскопическое исследование. При эндоскопии производят осмотр пищевода, желудка, двенадцатиперстной кишки. При выраженной атрофии слизистая оболочка желудка имеет характерные отличия в сравнении с таковой при, например, поверхностном гастрите.
Окончательный диагноз позволяет установить морфологический анализ биоптатов слизистой оболочки желудка, взятых во время эндоскопии. Морфологически атрофия определяется уменьшением числа функционирующих специализированных клеток желудка. Доказано, что при Н. pylori-ассоциированном гастрите процессы атрофии чаще возникают при инфицировании определенными штаммами (Cag A+ и Vac A+) Н. pylori. Одним из морфологических признаков атрофического гастрита является кишечная метаплазия, которая традиционно рассматривалась как предраковое изменение слизистой оболочки желудка.
Другие методы исследования — рентгенография желудка, ультразвуковое исследование брюшной полости и компьютерная томография — в плане диагностики атрофического гастрита неинформативны.
Чего нужно опасаться при атрофическом гастрите? Каков прогноз болезни?
Гипотетически наличие атрофического гастрита при естественном течении может иметь два сценария. Первый — длительно существующий хронический гастрит приводит к значительному уменьшению кислотообразующей функции желудка, требующему заместительной терапии, без которой будут наблюдаться признаки нарушения пищеварительной функции. Второй вариант — в результате длительного хронического персистирующего воспаления в слизистой оболочке желудка, характерного для Н. pylori-ассоциированного гастрита, происходит нарушение клеточного обновления в желудке, что способствует появлению клеток-мишеней для влияния на них канцерогенных веществ, в дальнейшем — к клеточным мутациям. В результате нормальный клеточный эпителий желудка замещается метапластическим, диспластическим и неопластическим.
По определению ВОЗ, под дисплазией понимают такие клеточные изменения, при которых часть эпителия замещена клетками с различной степенью атипии. В международной классификации эпителиальных неоплазий пищеварительного тракта (2000) дисплазия — это неоплазия, другими словами — опухоль. Итак, атрофический гастрит может трансформироваться в рак желудка. Наибольшую опасность в плане развития рака представляет атрофический гастрит с пониженной кислотообразующей функцией желудка (частота возникновения рака — до 13%). Среди известных в настоящее время молекулярных механизмов, лежащих в основе наследственной предрасположенности к раку желудка, выделены: индукция экспрессии TGF-β1, частичный полиморфизм кластера гена IL-1 (IL-1β). В результате развития атрофии слизистой оболочки желудка снижается ее противоопухолевая защита, создаются условия для активного воздействия канцерогенов. При возникновении тяжелой атрофии эпителия тела желудка риск развития рака желудка повышается в 5 раз в сравнении с таковым при неатрофическом гастрите.
Бактерии Н. pylori относят к биологическим канцерогенам в отношении рака желудка. Большинство исследователей считают, что Н. pylori — это основной этиологический фактор развития хронического гастрита, который является обязательным звеном в каскаде процессов, приводящих к раку желудка. На основании анализа результатов многоцентровых исследований Международное агенство по изучению рака при ВОЗ еще в 1994 году рекомендовало считать инфекцию Н. pylori абсолютным канцерогеном для человека.
В настоящее время рак желудка рассматривается как конечный результат длительного многоступенчатого и многофакторного процесса, в котором клеточные изменения слизистой оболочки желудка обусловлены нарушениями микроокружения. Этот процесс называют именем описавшего его автора — каскадом Корреа (1995). Он включает хронический гастрит, кишечную метаплазию, дисплазию и рак. Н. рylori-ассоциированный желудочный канцерогенез — многоэтапный процесс, характеризующийся развитием хронического гастрита — первой ступени в эволюционном каскаде. Последующие изменения приводят к формированию атрофии, тонкокишечной (I и II типы) и толстокишечной (III тип) метаплазий и дисплазии желудочного эпителия, в итоге — к аденокарциноме желудка. Именно атрофический гастрит занимает срединное положение в цепи вышеперечисленных изменений на пути к раку желудка.
Как избежать трансформации атрофического гастрита в рак желудка?
Ответ на данный вопрос состоит из равных по значимости частей: как можно раннее выявление предраковых изменений, их адекватное лечение и предупреждение (профилактика) проявления последних. При наблюдении больных хроническим гастритом важно уловить тот момент, когда возникает и начинает прогрессировать атрофия слизистой оболочки желудка, причем желательно это проводить простым информативным и неинвазивным способом.
Своевременное выявление атрофии слизистой оболочки желудка — первый диагностический этап выявления риска по раку желудка.
Многочисленные исследования последних лет показали, что очаги полной и неполной кишечной метаплазии слизистой оболочки желудка нельзя расценивать в качестве достоверного маркера повышенного риска развития рака желудка. Исследования свидетельствуют, что значительно важнее оценка не типа метаплазии, а ее объема. Так, при большом объеме метаплазии, превышающем 20% поверхности желудочного эпителия, создаются реальные условия для развития дисплазии с последующим образованием аденокарциномы желудка. Следовательно, риск развития рака желудка повышается при тяжелой атрофии желудочного эпителия, характеризующейся обширными очагами кишечной метаплазии.
Как же на практике определить площадь такого поражения? Следует помнить, что данные изменения происходят на клеточном уровне, и при обычной эндоскопии их распознать невозможно. Доступным и эффективным способом диагностики метапластических изменений в слизистой оболочке желудка является метод хромогастроскопии — прижизненная окраска слизистой желудка красителем (чаще метиленовым синим), проводимая во время эндоскопического исследования. Данная методика основана на поглощении красителя очагами кишечной метаплазии, что позволяет оценить их размеры, выполнить прицельную биопсию для гистологического анализа биоптата слизистой и выявить возможную дисплазию или метаплазию.
Вместе с тем морфологическая диагностика атрофического гастрита сопряжена с рядом трудностей. Сложность постановки диагноза атрофии морфологическим методом обусловлена тем, что на ранних стадиях процесс никогда не бывает диффузным, следовательно, результаты гастробиопсии могут способствовать гипер- и гиподиагностике. При воспалении может изменяться микроскопическая картина и неадекватно оцениваться проявления атрофического гастрита из-за ложного вывода о потере желез. Высока и субъективность методики. Все это заставляет искать другие надежные пути тестирования атрофических изменений слизистой оболочки желудка.
Разработан ряд малоинвазивных гематологических тестов (тестовая панель Biohit), позволяющих избежать ошибок диагностики, дать совокупную оценку состояния слизистой оболочки желудка, степени ее атрофии и потери нормальных желез и клеток в антральном отделе и теле желудка.
Во время проведения эндоскопического исследования обязательно должна проводиться детекция на наличие Н. pylori. При этом наиболее целесообразным следует признать уреазный или гистологический методы (из гастробиоптатов) исследования.
Определение уровня сывороточного пепсиногена (S-PGІ) или соотношения содержания пепсиногена I к пепсиногену II (PGI/PGII) — неэндоскопический метод диагностики атрофического гастрита с поражением тела желудка. С увеличением степени атрофии слизистой оболочки тела желудка (потеря нормальных кислотообразующих желез) уровни S-PGI и PGI/PGII постепенно снижаются. Определение уровня гастрина в сыворотке крови, преимущественно гастрина-17 (S-G-17), может быть использовано в качестве индикатора морфологического состояния слизистой оболочки антрального отдела желудка. То есть снижение S-G-17 является биохимическим маркером атрофического гастрита с поражением антрального отдела желудка (потеря антральных G-клеток).
Снижение уровней S-G-17 и S-PGI можно рассматривать как результат прогрессирующего атрофического гастрита с потерей нормальных желез и клеток слизитой оболочки тела и антрального отдела желудка. G-17 практически полностью синтезируются и секретируются G-клетками антрального отдела желудка. Эти клетки являются компонентами нормальных антральных желез, в случае прогрессирования атрофического гастрита их количество уменьшается на фоне поражения антральных желез и появления кишечной метаплазии. При Н. pylori-ассоциированном гастрите имеется тенденция к возрастанию серологических уровней G-17 и PGI. Низкая внутрижелудочная кислотность способствует увеличению серологического уровня G-17, и наоборот.
Перманентная длительная гипо- или ахлоргидрия приводят к чрезвычайно высоким уровням G-17 в крови. Особенно часто это наблюдается при пониженной кислотности (атрофический гастрит с поражением тела желудка) в сочетании с сохраненной слизистой оболочкой антрального отдела. Такая клиническая картина наиболее характерна для аутоиммунного атрофического гастрита. Если в антральном отделе имеются сопутствующие признаки атрофии слизистой оболочки (мультифокальный атрофический гастрит), тогда содержание S-G-17 не возрастает, и тестовая панель показывает низкие значения уровней S-PGI и S-G-17.
Совокупная точность тестовой панели в диагностике атрофического гастрита — около 80% (при сопоставлении с результатами эндоскопии и биопсии). Данная тестовая панель является малоинвазивной альтернативой первоначального обследования пациентов с подозрением на желудочную атрофию и дисплазию. Она позволяет надежно выявлять пациентов с различными формами гастрита, определять локализацию и этиологию патологического процесса, оценивать вероятность развития рака желудка и выстраивать дальнейшую тактику ведения больного.
Учитывая связь возникновения атрофии желудочного эпителия и кишечной метаплазии с инфекцией Н. pylori, становится очевидным выбор метода лечения и профилактики дальнейшего прогрессирования процесса. Методом выбора является антихеликобактерная терапия.
В 2002 году японские исследователи убедительно доказали возможность регрессии метапластических изменений слизистой оболочки желудка после успешного уничтожения бактерий Н. pylori. С помощью хромоскопии им удалось установить, что в течение пяти лет после проведения успешной антихеликобактерной терапии размеры очагов кишечной метаплазии уменьшились почти в 2 раза в сравнении с исходными. В последующих исследованиях подтвердилась целесообразность такого терапевтического подхода.
В настоящее время не вызывает сомнений необходимость проведения антихеликобактерной терапии пациентам с атрофическим гастритом. Предварительные данные нескольких многоцентровых исследований по мониторингу Н. pylori-ассоциированного предрака и рака желудка свидетельствуют в пользу реверсии воспаления слизистой оболочки желудка и связанных с ней атрофии, кишечной метаплазии и генетической нестабильности. В связи с этим в идеале пациентам с Н. pylori-позитивным хроническим атрофическим гастритом необходимо проводить эрадикационную терапию, а при отсутствии эффекта — исследование с целью выявления маркеров генетической нестабильности и тщательный мониторинг.
Данная рекомендация нашла отражение в международных рекомендациях по диагностике и лечению заболеваний, ассоциированных с Н. pylori — Маастрихтском консенсусе 3 (2005). Для уничтожения бактерий Н. pylori, как и в Маастрихтском консенсусе 2 (2000), рекомендованы трех- и четырехкомпонентные схемы антибактериальных препаратов в сочетании с ингибиторами протонной помпы (ИПП) в стандартных дозах: ИПП + кларитромицин + амоксициллин и ИПП + тетрациклин + метронидазол (фуразолидон) + коллоидный висмут.
Вместе с тем следует помнить, что полное восстановление структуры слизистой оболочки при тяжелой атрофии до нормы требует длительного времени, и в ряде случаев, по всей видимости, это не возможно. В случаях, когда предопухолевые процессы не подвергаются обратному развитию либо прогрессируют, необходимо применять более радикальные методы лечения, используя арсенал современных эндоскопических операций, вплоть до резекции слизистой оболочки желудка.
Главная цель первичной профилактики атрофического гастрита — своевременное и эффективное лечение поверхностного хеликобактерного гастрита. Для этого используют стандартные схемы антихеликобактерной терапии, в соответствии с рекомендациями Маастрихтских консенсусов 2 (2000) и 3 (2005). Важным моментом является последующий контроль за успешностью этой терапии. Контроль необходимо проводить с использованием неинвазивных методов (дыхательного уреазного или стул-теста). При неудачной эрадикации проводить повторные курсы лечения.
Кроме того, доказано, что, придерживаясь здорового режима питания, можно снизить онкологический риск (прогрессирование атрофии), что подтверждено в исследованиях, проведенных в ряде стран. Рекомендуется избегать употребления консервированных, маринованных и копченых продуктов, отказаться от курения и употребления крепких спиртных напитков (особенно в сочетании с жирной, жареной, копченой и соленой пищей), исключить переедание. Необходимо контролировать массу тела, выполнять активные физические нагрузки, употреблять больше свежих овощей (в том числе лук и чеснок), фруктов и натуральных соков, витаминов А, С, b-каротина, зелени, круп грубого помола, молочных продуктов. В некоторых развитых странах Европы и США внедрение здорового образа жизни привело к снижению заболеваемости раком желудка в несколько раз, сегодня это заболевание в этих странах считается редким, составляя лишь 3% среди злокачественных новообразований. Мониторирование — постоянное наблюдение с периодическим повторным обследованием — абсолютно обязательно для пациентов с атрофическим гастритом
Итак, в настоящее время очевидна необходимость особого внимания к атрофическому гастриту. Комплексное применение современных методов исследования — эндоскопического, морфологического, гематологического (тестовой панели) и других — способствует его точной диагностике. Использование эффективных методов лечения и профилактики атрофического гастрита, устранение условий, которые способствуют его развитию, представляют сегодня реальную возможность улучшить прогноз этого заболевания, устранить риск развития рака желудка.
Литература
1. Е.Г. Бурдина, Е.М. Майорова, Е.В. Григорьева, И.И.Тимофеева, О.Н. Минушкин // Гастрин-17 и пепсиноген І в оценке состояния слизистой оболочки желудка // Российский медицинский журнал, 2006, №2, с. 9-11.
2. Х. Ваананен, М. Ваухконен, Т. Хэлске, И. Каариянен, М. Расмуссен, Х. Тунтури-Хихнала, Дж. Коскенпато, М. Сотка, М. Турунен, Р. Сандстрем, М.Ристиканкаре, А. Юссила, П. Сиппонен // Неэндоскопическая диагностика атрофического гастрита на основании анализа крови: корреляция между результатами гистологического исследования желудка и уровнями гастрина-17 и пепсиногена І в сыворотке // Клинические перспективы гастроэнтерологии, гепатологии, 2003, № 4, с. 26-32.
3. В.Д. Пасечников, С.З. Чуков, С.М. Котелевец / Профилактика рака желудка на основе эрадикационной терапии предопухолевых заболеваний // Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 2003, № 4, с. 11-19.
4. А.А. Шептулин, В.А. Киприанис / Диагностика и лечение инфекции Helicobacter pylori: основные положения согласительного совещания «Маастрихт — 3» // Российский журнал гастроэнтерологии гепатологии колопроктологии, 2006, № 2, с. 88-91.
5. Kim N., Lim S. H., Lee K.H. et al. Long-term effects of Helicobacter pylori eradication on intestinal plasia in patients with duodenal and behign gastric ulcers Dig. Dis. Sci. — 2000. — Vol. 45. — 1754-1762.
6. Malfertheiner P., Megraud F., O’Morain C. еt al. Current concepts in the management of Helicobacter pylori infection — The Maastricht 2 Concensus Report // Aliment. Pharmacol. Ther. — 2002. — Vol. 16. — P. 167-180.
Источник